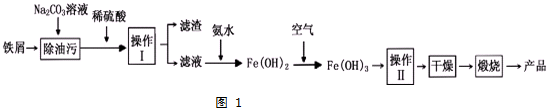
题目内容
16.下列物质的转化在给定条件下不能实现的是( )| A. | NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3$\stackrel{△}{→}$Al2O3(熔融)$\stackrel{电解}{→}$Al | |
| B. | Cu2(OH)2CO3$\stackrel{盐酸}{→}$CuCl2(aq)$\stackrel{电解}{→}$Cu | |
| C. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH(aq)}{→}$Na2SiO3(aq) | |
| D. | CuSO4(aq)$\stackrel{NaOH(aq)}{→}$Cu(OH)2悬浊液$→_{△}^{葡萄糖}$Cu2O |
分析 A.偏铝酸钠与过量的二氧化碳生成氢氧化铝,氢氧化铝不稳定受热分解生成氧化铝,氧化铝电解得到单质铝.
B.碱式碳酸铜为盐,与盐酸反应生成氯化铜,氯化铜电解生成铜和氯气;
C.二氧化硅不溶解于水,不与水反应,硅酸和氢氧化钠发生中和反应生成硅酸钠和水;
D.硫酸铜和氢氧化钠发生复分解反应生成氢氧化铜和硫酸钠,氢氧化铜和葡萄糖反应生成砖红色的氧化亚铜.
解答 解:A.碳酸的酸性强于氢氧化铝,偏铝酸钠与过量的二氧化碳生成氢氧化铝,氢氧化铝为难溶性的碱,受热易分解,生成氧化铝和水,氧化铝电解生成铝和氧气,物质的转化在给定条件下能实现,故A不选;
B.碱式碳酸铜为盐,与盐酸反应生成氯化铜和水、二氧化碳,氯化铜溶液电解生成铜和氯气,物质的转化在给定条件下能实现,故B不选;
C.二氧化硅和水不反应,无法一步转化为硅酸,故C选;
D.硫酸铜和氢氧化钠发生复分解反应生成氢氧化铜和硫酸钠,葡萄糖具有还原性,氢氧化铜和葡萄糖发生复分解反应,生成砖红色的氧化亚铜,物质的转化在给定条件下能实现,故D不选;
故选C.
点评 本题考查元素化合物的性质,题目难度不大,熟练掌握物质的性质,正确运用物质分类及反应规律则是解决此类问题的有效方法.

练习册系列答案
相关题目
6.下列说法正确的是( )
| A. |  的系统命名是2,3-二甲基戊烷 的系统命名是2,3-二甲基戊烷 | |
| B. | 向鸡蛋清溶液中分别加入(NH4)2SO4和CuSO4溶液都能使鸡蛋清聚沉,其作用原理相同 | |
| C. | 丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与足量的氢气充分反应后的产物也不是同系物 | |
| D. | 等物质的量的乙炔、乙醛、(HO)CH2-CH2(OH)完全燃烧时的耗氧量相等 |
4.工业合成尿素反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率与B点的逆反应速率的关系:v正(CO2)>v逆(CO2)(填“>”、“<”或“=”)
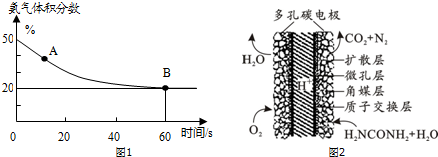
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)?NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
①关于上述反应的焓变、熵变说法正确的是A
A.△H<0,△S<0B.△H>0,△S<0
C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
(3)化学家正在研究尿素动力燃料电池,尿液也能发电.用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率与B点的逆反应速率的关系:v正(CO2)>v逆(CO2)(填“>”、“<”或“=”)

(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)?NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.△H<0,△S<0B.△H>0,△S<0
C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
(3)化学家正在研究尿素动力燃料电池,尿液也能发电.用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
11.下列做法与可持续发展宗旨相违背的是( )
| A. | 改善能源结构,大力发展太阳能、风能等清洁能源 | |
| B. | 推广碳捕集和储存技术,逐步实现二氧化碳零排放 | |
| C. | 推广使用煤液化、气化技术,减少二氧化碳的排放 | |
| D. | 工业废水、生活污水净化处理,减少污染物的排放 |
1.下列有关说法正确的是( )
| A. | 铅蓄电池放电过程中,正极质量增加,负极质量减小 | |
| B. | 反应NH4Cl(s)=NH3(g)+HCl(g)在室温下不能自发进行,则该反应的△H>0 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 0.1 mol•L-1 CH3COOH溶液加水稀释后,溶液中c(OH-)、CH3COOH浓度均减少 |
8.已知W、X、Y、Z、R是短周期中原子序数依次增大的5种主族元素,其中W、Z同族,且原子序数相差8,元素X在同周期的主族元素中原子半径最大,Y是地壳中含量最多的金属元素.下列说法中正确的是( )
| A. | 气态氢化物稳定性:R>Z>W | |
| B. | 原子半径:R<W<Y<Z<X | |
| C. | X分别与W、R形成的化合物的化学键类型不一定相同 | |
| D. | 电解X与R形成化合物的溶液可获得X的单质 |
5.硼在化合物中一般显正价.可用下述方法合成储氢材料氨硼烷:LiBH4+NH4Cl=NH3BH3+LiCl+H2↑.NH3BH3在催化剂存在时可以与水发生催化脱氢反应:NH3BH3+2H2O$\frac{\underline{\;催化剂\;}}{\;}$NH4BO2+3H2↑.下列有关说法正确的是( )
| A. | NH3BH3中H元素均为+1价 | |
| B. | 合成反应中每生成1 mol NH3BH3会转移2 mol e- | |
| C. | 两个反应中,H2均既是氧化产物,又是还原产物 | |
| D. | 0.1 mol NH3BH3发生上述催化脱氢反应,一定生成6.72 L H2 |

 .
. .
. )的合成路线:
)的合成路线: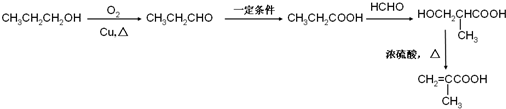 .
.