题目内容
已知某一反应体系有反应物和生成物共三种物质:FeCl3、FeCl2、Fe.完成下列问题:
(1)该反应中的还原产物的化学式是 ,还原剂的化学式是 .
(2)该反应的离子方程式 .
(3)标出该反应中电子转移的方向和数目 .
(4)如果反应中转移了0.3mol电子,则 (填“溶解”或“生成”)的铁的质量为 .
(1)该反应中的还原产物的化学式是
(2)该反应的离子方程式
(3)标出该反应中电子转移的方向和数目
(4)如果反应中转移了0.3mol电子,则
考点:氧化还原反应
专题:氧化还原反应专题
分析:FeCl3具有氧化性,Fe具有还原性,二者发生氧化还原反应生成FeCl2,反应中只有Fe元素化合价发生变化,则FeCl2既是氧化产物又是还原产物,结合元素化合价的变化解答该题.
解答:
解:(1)FeCl3具有氧化性,Fe具有还原性作还原剂,二者发生氧化还原反应生成FeCl2,反应中只有Fe元素化合价发生变化,则FeCl2既是氧化产物又是还原产物,
故答案为:FeCl2;Fe;
(2)反应的化学方程式为2FeCl3+Fe=3FeCl2,离子方程式为2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(3)Fe作还原剂失去2个电子,单线桥表示电子转移方向和数目为: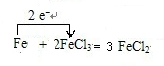 ,故答案为:
,故答案为: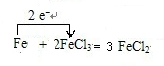 ;
;
(4)反应中Fe元素化合价分别由0价、+3价变化为+2价,则消耗1molFe转移2mol电子,所以转移0.3mol电子消耗0.15molFe,质量为0.15mol×56g/mol=8.4g,
故答案为:溶解;8.4g.
故答案为:FeCl2;Fe;
(2)反应的化学方程式为2FeCl3+Fe=3FeCl2,离子方程式为2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(3)Fe作还原剂失去2个电子,单线桥表示电子转移方向和数目为:
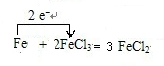 ,故答案为:
,故答案为: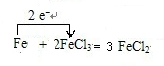 ;
;(4)反应中Fe元素化合价分别由0价、+3价变化为+2价,则消耗1molFe转移2mol电子,所以转移0.3mol电子消耗0.15molFe,质量为0.15mol×56g/mol=8.4g,
故答案为:溶解;8.4g.
点评:本题考查氧化还原反应,为高考中的经典题型,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度分析并解答该题,题目难度不大.

练习册系列答案
相关题目
在某无色透明的酸性溶液中能大量共存的离子组的是( )
| A、Na+、NO3-、Al3+、SO42- |
| B、Na+、CO32-、K+、NO3- |
| C、MnO4-、K+、SO42-、Na+ |
| D、K+、SO42-、HCO3-、Na+ |
XeF4在水中发生反应:6XeF4+12H2O=2XeO3+4Xe↑+24HF+3O2↑下列判断中正确的是( )
| A、XeF4分子中各原子均达到8电子稳定结构 |
| B、XeF4分子中Xe的化合价为0价 |
| C、氧化剂和还原剂的物质的量之比为2:3 |
| D、每生成4 molXe转移16 mol电子 |
下列说法正确的是( )
| A、1mol CO2的体积约是22.4L |
| B、1mol氦气中含有2NA个原子 |
| C、0.3molN2、0.7molO2的混合气体在标准状况下的体积约为22.4L |
| D、1mol H2SO4所含粒子数为NA个 |
下列有关仪器使用方法或实验操作正确的是( )
| A、在制取干燥纯净的氯气时,先使氯气通过饱和食盐水,后通过浓硫酸 |
| B、准确量取25.00mL高锰酸钾溶液,可选用50mL量筒 |
| C、测定中和热时,为了减少热量损失,不要搅拌溶液 |
| D、分离乙醇和乙酸乙酯的混合物用到的玻璃仪器是分液漏斗和烧杯 |
从金银花中提取得到的绿原酸具有抗菌、消炎、解毒、利胆、降压等功效,广泛用于医药,化妆品等领域.绿原酸的结构为: 下列关于该化合物的说法不正确的是( )
下列关于该化合物的说法不正确的是( )
 下列关于该化合物的说法不正确的是( )
下列关于该化合物的说法不正确的是( )| A、1mol绿原酸最多可与4mol NaOH发生反应 |
| B、与乙醇发生酯化反应后的有机物分子式为C18H24O9 |
| C、1mol绿原酸最多可与4 mol Br2发生反应 |
| D、能发生加成、取代、氧化、消去反应,也能发生还原反应 |
 .
.




