题目内容
6.碳酸二甲酯(DMC)是一种低毒性的绿色化学品,可用于代替高毒性的光气(COCl2)作羰基化试剂.DMC的合成路线如图.完成下列填空.
已知:RCO-OR1+R2O-H→RCO-OR2+R1O-H (称酯交换反应)
(1)写出反应类型:反应①加成反应;
(2)写出结构简式:XOHCH2CH2OH;
(3)已知物质Y与DMC互为同分异构体,Y的水溶液呈酸性,在一定条件下2molY能生成1mol分子中含六元环结构的有机物Z,则Z的结构简式为
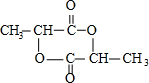 ;
;(4)DMC与双酚(
 )在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n
)在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n +n
+n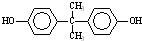 →
→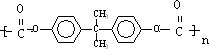 +4nCH3OH.
+4nCH3OH.
分析 由合成流程可知,反应①为加成反应生成环氧乙烷,反应②为C=O键的加成反应,反应③为C与甲醇的取代反应生成DMC( )和X(OHCH2CH2OH),然后结合有机物的结构与性质来解答.
)和X(OHCH2CH2OH),然后结合有机物的结构与性质来解答.
解答 解:由合成流程可知,反应①为加成反应生成环氧乙烷,反应②为C=O键的加成反应,反应③为C与甲醇的取代反应生成DMC( )和X(OHCH2CH2OH),
)和X(OHCH2CH2OH),
(1)由上述分析可知,①为加成反应,
故答案为:加成反应;
(2)由上述分析可知,X为OHCH2CH2OH,
故答案为:OHCH2CH2OH;
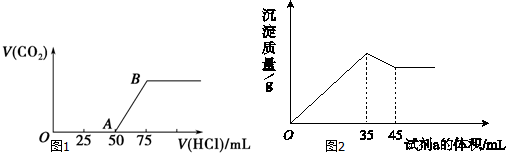
(3)Y与DMC互为同分异构体,Y的水溶液呈酸性,在一定条件下2mol Y能生成1mol分子中含六元环结构的有机物Z,Y中含1个-COOH,则Y的结构简式为CH3CH(OH)COOH,Z为 ,
,
故答案为: ;
;
(4)DMC与双酚( )在一定条件下可生成芳香族聚碳酸酯,反应的化学方程式为:2n
)在一定条件下可生成芳香族聚碳酸酯,反应的化学方程式为:2n +n
+n →
→ +4nCH3OH,
+4nCH3OH,
故答案为:2n +n
+n →
→ +4nCH3OH.
+4nCH3OH.
点评 本题考查有机物推断与合成、有机反应类型、同分异构体书写等,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质,易错点为(4),注意理解给予信息.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.将自来水管与下列材料做成的水龙头连接,使铁水管锈蚀最快的水龙头是( )
| A. | 铁水龙头 | B. | 陶瓷水龙头 | C. | 铜水龙头 | D. | 锌水龙头 |
17. 2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
 2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )| A. | 异胡薄荷醇遇FeCl3溶液显紫色 | |
| B. | 异胡薄荷醇可发生消去反应、加成反应 | |
| C. | 青蒿素分子中含有7个手性碳原子 | |
| D. | 青蒿素在热的酸、碱溶液中均可稳定存在 |
14.最近我校主楼门前矗立起一块电子显示屏,时时显示校园周围环境的数据变化.其中一项是有关环境中PM2.5的内容,下列有关PM2.5的说法不正确的是( )
| A. | PM2.5是指直径为2.5pm颗粒物 | |
| B. | PM2.5造成的雾霾天气,空气质量很差,对人体健康危害极大 | |
| C. | 空气中的PM2.5,表示每立方米空气中直径小于或等于2.5um的颗粒物的含量,则PM2.5可能导致空气形成气溶胶 | |
| D. | 无风雾霾中的PM2.5的运动应属于布朗运动 |
18.金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”.以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如图1.
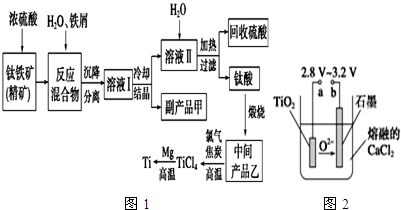
请回答下列问题.
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为FeTiO3;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为FeTiO3+2H2SO4═TiOSO4+FeSO4+2H2O
(2)上述生产流程中加入铁屑的目的是防止Fe2+氧化.此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于10时,Mg(OH)2开始沉淀.
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为TiO2++2H2O═TiO(OH)2↓(或H2TiO3)+2H+).
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为TiO2+2C+2Cl2=TiCl4+2CO.Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是隔绝空气.除去所得金属钛中少量的金属镁可用的试剂是稀盐酸.
(4)在800~1 000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的正极,阴极的电极反应式为TiO2+4e-═Ti+2O2-.

请回答下列问题.
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为FeTiO3;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为FeTiO3+2H2SO4═TiOSO4+FeSO4+2H2O
(2)上述生产流程中加入铁屑的目的是防止Fe2+氧化.此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为TiO2++2H2O═TiO(OH)2↓(或H2TiO3)+2H+).
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为TiO2+2C+2Cl2=TiCl4+2CO.Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是隔绝空气.除去所得金属钛中少量的金属镁可用的试剂是稀盐酸.
(4)在800~1 000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的正极,阴极的电极反应式为TiO2+4e-═Ti+2O2-.
16.下列实验操作或对实验事实的叙述不正确的是( )
| A. | 取用钠、钾、白磷时,没用完的药品要放回原瓶 | |
| B. | 用pH试纸测得氯水的pH为2 | |
| C. | 氯水、硝酸银溶液存放在配有磨口塞的棕色细口瓶中 | |
| D. | 金属钠着火时,用细沙覆盖灭火 |