题目内容
1.某相对分子质量为26的烃A,是一种重要的有机化工原料,以A为原料在不同的反应条件下可以转化为烃B、烃C,且B、C的核磁共振谱显示都只有一种氢,B分子中碳碳键的键长有两种.以C为原料通过下列方案可以制备具有广谱高效食品防腐作用的有机物M,M分子的球棍模型如图所示(图中球与球之间连线表示单键或双键).
(1)A的分子式是C2H2.
(2)B能使溴的四氯化碳溶液褪色,则B的结构简式为
 .
.(3)C→D的反应类型为加成反应.
(4)写出E→F的化学方程式
 .
.(5)G中的含氧官能团的名称是羧基、羟基,写出由G反应生成高分子的化学反应方程式
 .
.(6)M的同分异构体有多种,写出两种满足以下条件的同分异构体的结构简式:

①能发生银镜反应
②含有苯环且苯环上一氯取代物有两种
③遇FeCl 3溶液不显紫色
④1mol该有机物与足量的钠反应生成1mol氢气(一个碳原子上同时连接两个-OH的结构不稳定)
分析 某相对分子质量为26的烃A,则A是HC≡CH,以A为原料在不同的反应条件下可以转化为烃B、烃C,B的相对分子质量为104,B分子中C原子最大数目为$\frac{104}{12}$=8…8,由C、H原子关系可知,B含有8个C原子,则B为C8H8,C的相对分子质量为78,则C分子中碳原子最大数目为$\frac{78}{12}$=6…6,则C分子式为C6H6,B和C分子的核磁共振氢谱中都有一个吸收峰,说明B和C都只有一种类型的氢原子,B能使溴的四氯化碳溶液褪色,B含有不饱和键,结合B、C的分子式知,B是1,3,5,7-环辛四烯( ),结合转化关系可知C为
),结合转化关系可知C为 .以C为原料可以制备有机物M,根据M分子的球棍模型知,M是对羟基苯甲酸乙酯,所以其分子式为:C9H10O3.G和醇发生酯化反应生成M,根据M的结构简式知,G是对羟基苯甲酸(
.以C为原料可以制备有机物M,根据M分子的球棍模型知,M是对羟基苯甲酸乙酯,所以其分子式为:C9H10O3.G和醇发生酯化反应生成M,根据M的结构简式知,G是对羟基苯甲酸( ).
). 被酸性高锰酸钾氧化生成E,则E是对氯苯甲酸(
被酸性高锰酸钾氧化生成E,则E是对氯苯甲酸( ),对氯苯甲酸和氢氧化钠的水溶液发生取代反应生成F,F的结构简式为:
),对氯苯甲酸和氢氧化钠的水溶液发生取代反应生成F,F的结构简式为: .D和氯气反应生成
.D和氯气反应生成 ,根据碳原子守恒知,B和丙烯发生加成反应生成D,D和氯气发生取代反应生成
,根据碳原子守恒知,B和丙烯发生加成反应生成D,D和氯气发生取代反应生成 ,则D的结构简式为:
,则D的结构简式为: ,据此解答.
,据此解答.
解答 解:某相对分子质量为26的烃A,则A是HC≡CH,以A为原料在不同的反应条件下可以转化为烃B、烃C,B的相对分子质量为104,B分子中C原子最大数目为$\frac{104}{12}$=8…8,由C、H原子关系可知,B含有8个C原子,则B为C8H8,C的相对分子质量为78,则C分子中碳原子最大数目为$\frac{78}{12}$=6…6,则C分子式为C6H6,B和C分子的核磁共振氢谱中都有一个吸收峰,说明B和C都只有一种类型的氢原子,B能使溴的四氯化碳溶液褪色,B含有不饱和键,结合B、C的分子式知,B是1,3,5,7-环辛四烯( ),结合转化关系可知C为
),结合转化关系可知C为 .以C为原料可以制备有机物M,根据M分子的球棍模型知,M是对羟基苯甲酸乙酯,所以其分子式为:C9H10O3.G和醇发生酯化反应生成M,根据M的结构简式知,G是对羟基苯甲酸(
.以C为原料可以制备有机物M,根据M分子的球棍模型知,M是对羟基苯甲酸乙酯,所以其分子式为:C9H10O3.G和醇发生酯化反应生成M,根据M的结构简式知,G是对羟基苯甲酸( ).
). 被酸性高锰酸钾氧化生成E,则E是对氯苯甲酸(
被酸性高锰酸钾氧化生成E,则E是对氯苯甲酸( ),对氯苯甲酸和氢氧化钠的水溶液发生取代反应生成F,F的结构简式为:
),对氯苯甲酸和氢氧化钠的水溶液发生取代反应生成F,F的结构简式为: .D和氯气反应生成
.D和氯气反应生成 ,根据碳原子守恒知,B和丙烯发生加成反应生成D,D和氯气发生取代反应生成
,根据碳原子守恒知,B和丙烯发生加成反应生成D,D和氯气发生取代反应生成 ,则D的结构简式为:
,则D的结构简式为: ,
,
(1)通过以上分析知,A是乙炔,其分子式为:C2H2,
故答案为:C2H2;
(2)B能使溴水褪色,说明B中含有不饱和键,通过以上分析知,B的结构简式为: ,
,
故答案为: ;
;
(3)苯和丙烯发生加成反应生成 ,
,
故答案为:加成反应;
(4)对氯苯甲酸和氢氧化钠的水溶液发生取代反应生成F和氯化钠、水,反应方程式为: ,
,
故答案为: ;
;
(5)G是对羟基苯甲酸,其含氧官能团是羧基、羟基,对羟基苯甲酸发生缩聚反应生成高分子化合物,反应方程式为: ,
,
故答案为:羧基、羟基, ;
;
(6)M是对羟基苯甲酸乙酯,M的同分异构体有多种,符合下列条件:
①能发生银镜反应说明含有醛基;
②含有苯环,苯环上有两个侧链且苯环上一氯取代物有两种说明苯环上两个支链处于对位;
③遇FeCl3溶液不显紫色,说明不含酚羟基;
④1mol该有机物与足量的钠反应生成1mol氢气(一个碳原子上不同时连接两个-OH),说明含有两个醇羟基和一个醛基,则符合条件的M的同分异构体有: ,
,
故答案为: .
.
点评 本题考查了有机物的推断,明确有机物的官能团及其性质是解本题关键,以乙炔为突破口采用正逆相结合的方法进行推断,注意苯环上连接苯环的碳原子上有氢原子时,该支链能被酸性高锰酸钾氧化生成甲酸基,为易错点.

 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案①NaHCO3═Na++H++CO32-
②NaHSO4═Na++H++SO42-
③H2SO4═2H++SO42-
④KClO3═K++Cl-+3O2-.
| A. | ①② | B. | ① | C. | ①④ | D. | ③④ |
| A. | 与AlCl3溶液发生反应的离子方程式为Al3++3OH-═Al(OH)3↓ | |
| B. | 加水稀释,氨水的电离平衡向逆反应方向移动 | |
| C. | 用HNO3溶液恰好完全中和,中和后溶液不显中性 | |
| D. | 其溶液的pH=13 |
| A. | 泡沫灭火器的工作原理是:2Al3++3CO32-+3H2O═2Al(0H)3↓+3CO2↑ | |
| B. | 石墨为电极电解 FeCl 2溶液,阳极电极反应式为:2Cl--2e-═Cl2↑ | |
| C. | 实验室中加热熟石灰和氯化铵制氨气:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 向Ba(OH)2溶液中加入少量的NH4HCO3溶液:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O |
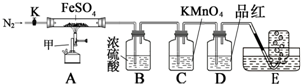 硫酸亚铁晶体(FeSO4•7H2O)俗称绿矾,加热至高温会分解.某化学研究小组利用如图装置探究FeSO4分解后的产物.
硫酸亚铁晶体(FeSO4•7H2O)俗称绿矾,加热至高温会分解.某化学研究小组利用如图装置探究FeSO4分解后的产物.实验步骤:
按图组装好仪器(已省略夹持仪器)并检查装置的气密性,准确称取m gFeSO4固体置于硬质玻璃管中,将E中的导管撤出水槽,打开活塞K,通入一段时间的N2,关闭活塞K.加热A中的玻璃管一段时间后,将E中导管置于水槽集气瓶口收集产生的气体,用带火星的木条检验E中所收集的气体,带火星的木条能够复燃.待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,得到红棕色粉末.请回答下列问题:
(1)仪器甲的名称是酒精喷灯;
(2)B中浓硫酸的作用吸收分解产生的SO3;
(3)实验过程中发现C中溶液颜色变浅,D中无明显变化.写出C中发生反应的离子方程式5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(4)FeSO4完全分解后,还需要通入一段时间N2的原因是将装置内残留的气体排入吸收装置2完全吸收,同时防止发生倒吸;
(5)若C中原先加入了20mL 1.00mol/L的KMnO4溶液,为了确定FeSO4分解的化学方程式,某同学进行了如下实验:
I、称量B装置在实验前后增重0.80g;
II、将实验后C中的溶液全部转移至100mL容量瓶中,并加水稀释至刻度线;
III、准确量取20.00mL溶液至锥形瓶中,加入足量稀硫酸酸化,用0.20mol/L标准H2C2O4溶液滴定至终点;
IV、重复实验3次,记录数据如表
| 实验 | 滴定管开始读数 | 滴定终点读数 |
| 1 | 0 | 19.98 |
| 2 | 0.10 | 20.12 |
| 3 | 0 | 20.16 |
②FeSO4分解的化学方程式为8FeSO4 $\frac{\underline{\;高温\;}}{\;}$4Fe2O3+2SO3↑+6SO2↑+O2↑;
(6)请设计一个实验来检验A中的FeSO4是否完全分解将废液后的固体转移到小烧杯中,加入少量水搅拌过滤,取少量滤液于试管中,加入几滴K3[Fe(CN)6]溶液,若产生特征蓝色沉淀,说明硫酸亚铁未全部分解,反之则分解完全.
| A. | X-二氧化硫,Y-氢氧化钠溶液 | B. | X-氢氧化钠溶液,Y-硫酸铝溶液 | ||
| C. | X-二氧化碳,Y-偏铝酸钠溶液 | D. | X-二氧化碳,Y-饱和碳酸钠溶液 |
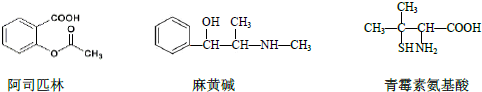
| A. | 三种有机物都能发生酯化反应 | |
| B. | 阿司匹林的苯环上的一氯代物有3 种 | |
| C. | 麻黄碱的分子式是C10H15NO,苯环上的一硝基取代物有3 种 | |
| D. | 青霉素氨基酸既能与盐酸反应,又能与NaOH 溶液反应 |