题目内容
下列说法正确的是(NA表示阿伏加德罗常数)( )
| A、在常温常压下,11.2LN2含有的原子数为1NA |
| B、在标准状况下,34g NH3含有的电子数为为17NA |
| C、在常温常压下,71gCl2所含原子数为2NA |
| D、23g钠在化学反应中失去电子数目为10NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、常温常压下,气体摩尔体积不是22.4L/mol;
B、根据n=
并结合1mol氨气含10mol电子来分析;
C、根据n=
并结合1mol氯气含2mol氯原子来分析;
D、根据n=
并结合1mol钠失去1mol电子来分析.
B、根据n=
| m |
| M |
C、根据n=
| m |
| M |
D、根据n=
| m |
| M |
解答:
解:A、常温常压下,气体摩尔体积不是22.4L/mol,故11.2LN2的物质的量不是0.5mol,含有的原子数不是NA,故A错误;
B、氨气的物质的量n=
=
=2Mol,而1mol氨气含10mol电子,故2mol氨气含20mol电子,个数为20NA,故B错误;
C、氯气的物质的量n=
=
=1mol,而1mol氯气含2mol氯原子,个数为2NA个,故C正确;
D、钠的物质的量n=
=
=1mol,而1mol钠失去1mol电子,个数为NA个,故D错误;
故选C.
B、氨气的物质的量n=
| m |
| M |
| 34g |
| 17g/mol |
C、氯气的物质的量n=
| m |
| M |
| 71g |
| 71g/mol |
D、钠的物质的量n=
| m |
| M |
| 23g |
| 23g/mol |
故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
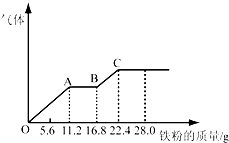 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示.下列分析或结果不正确的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示.下列分析或结果不正确的是( )| A、混合酸中HNO3物质的量浓度为2mol?L-1 |
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 |
| C、原混合酸中H2SO4物质的量为0.4 mol |
| D、第二份溶液中最终溶质为FeSO4 |
下列描述正确的是( )
| A、摩尔是国际单位制中的一个基本物理量 |
| B、萃取操作时,可以选择有机萃取剂,且萃取剂的密度必须比水大 |
| C、当光束分别通过氢氧化铁胶体、氯化铁溶液时,都可以从侧面看见光亮的通路 |
| D、根据分散质粒子的直径大小,分散系可分为溶液、胶体和浊液 |
固体X只可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3、AgNO3中的一种或几种组成,某同学对该固体进行了如图实验:
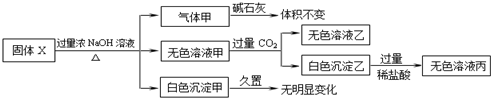
下列判断正确的是( )

下列判断正确的是( )
| A、气体甲一定是纯净物 |
| B、白色沉淀甲可能是混合物 |
| C、固体X中一定存在AlCl3、(NH4)2SO4、MgCl2 |
| D、固体X中一定不存在FeCl2、AgNO3 |

 现有一盛有常见固体物质M的试剂瓶,标签已破损(如图所示),请根据其性质回答下列问题:
现有一盛有常见固体物质M的试剂瓶,标签已破损(如图所示),请根据其性质回答下列问题: