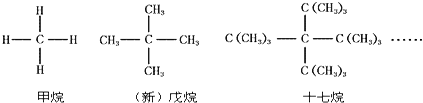
题目内容
9.下列各组离子在溶液中能大量共存的是( )| A. | Na+、H+、Cu2+、NO3- | B. | Na+、Fe2+、H+、NO3- | ||
| C. | NH4+、Cl-、SO42-、OH- | D. | HCO3-、I-、Na+、OH- |
分析 根据离子之间不能结合生成沉淀、气体、水、弱电解质等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.该组离子之间不反应,可大量共存,故A选;
B.Fe2+、H+、NO3-发生氧化还原反应,不能大量共存,故B不选;
C.NH4+、OH-结合生成弱电解质,不能大量共存,故C不选;
D.HCO3-、OH-结合生成水和碳酸根离子,不能大量共存,故D不选;
故选A.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
20.一定量的铁粉和9g硫粉混合加热,待其反应后再加入过量盐酸,将生成的气体完全燃烧,共收集得18g水,求加入的铁粉质量为( )
| A. | 14g | B. | 42g | C. | 56g | D. | 28g |
4.设NA为阿伏加德罗常数,则下列说法正确的是( )
| A. | 一定条件下,2.3g Na完全与O2反应生成3.6g产物时得到的电子数为0.1NA | |
| B. | 1L 0.1mol醋酸溶液中所含分子数少于0.1NA | |
| C. | 水分子中1mol羟基含有的电子总数为9NA | |
| D. | 1 mol H2O2含有极性共价键键数为NA,含有非极性共价键为键数2NA |
1. 锂空气电池(如图)两极分别采用有机电解液和水性电解液,中间以固体电解质膜(只允许Li+通过)隔开,下列说法正确的是( )
锂空气电池(如图)两极分别采用有机电解液和水性电解液,中间以固体电解质膜(只允许Li+通过)隔开,下列说法正确的是( )
 锂空气电池(如图)两极分别采用有机电解液和水性电解液,中间以固体电解质膜(只允许Li+通过)隔开,下列说法正确的是( )
锂空气电池(如图)两极分别采用有机电解液和水性电解液,中间以固体电解质膜(只允许Li+通过)隔开,下列说法正确的是( )| A. | 正极一侧为有机电解液 | B. | 放电过程中LiOH在正极生成 | ||
| C. | 放电时Li+从正极区移向负极区 | D. | 专用充电电极可以是铁、铜等金属 |
17.下表是25℃时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是( )
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ks或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向0.1mol•L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5 | |
| C. | 碳酸钠溶液中滴加少量氯水的离子方程式为CO2-3 +Cl2+H2O=HCO-3+Cl-+HClO | |
| D. | 向浓度均为1×10-3mol•L-1的KCl和K2CrO4混合液中滴加1×10-3mol•L-1的AgNO3溶液,CrO2-4先形成沉淀. |
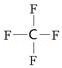
 ,1molO22+中含有的π键数目为2NA.
,1molO22+中含有的π键数目为2NA.