题目内容
下列有关说法正确的是( )
| A、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B、0.01 mol/L的氨水可以使酚酞试液变红,说明氨水是弱电解质 |
| C、FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
| D、在化学平衡、电离平衡、水解平衡中,平衡常数都随温度的升高而增大 |
考点:焓变和熵变,弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.依据反应能否自发进行的判据:△H-T△S解答;
B.电解质是化合物,氨水是氨的水溶液是混合物,氨水使酚酞变红,是碱的通性;
C.弱碱盐水解生成难挥发性强酸时,加热蒸干仍得到原物质;
D.升高温度化学平衡常数可能增大也可能减小.
B.电解质是化合物,氨水是氨的水溶液是混合物,氨水使酚酞变红,是碱的通性;
C.弱碱盐水解生成难挥发性强酸时,加热蒸干仍得到原物质;
D.升高温度化学平衡常数可能增大也可能减小.
解答:
解:A.反应能自发进行说明:△H-T△S<0,由方程式NH3(g)+HCl(g)═NH4Cl(s)可知该反应的<0,要使:△H-T△S<0,所以必须满足△H<0,故A正确;
B.0.01 mol/L的氨水可以使酚酞试液变红是碱的通性,强碱如氢氧化钠也有此类性质,所以不能证明氨水是弱电解质,弱电解质是化合物,氨水是氨的水溶液是混合物,故B错误;
C.弱碱盐水解生成难挥发性强酸时,加热蒸干仍得到原物质,FeCl3溶液加热蒸干、灼烧得到Fe2O3,Fe2(SO4)3溶液加热蒸干、灼烧得到Fe2(SO4)3,故C错误;
D.升高温度化学平衡常数可能增大也可能减小,若为放热反应,升高温度平衡逆移,平衡常数减小,若为吸热反应,升高温度平衡正移,则平衡常数增大,而电离平衡、水解平衡中,平衡常数都随温度的升高而增大,故D错误.
故选A.
B.0.01 mol/L的氨水可以使酚酞试液变红是碱的通性,强碱如氢氧化钠也有此类性质,所以不能证明氨水是弱电解质,弱电解质是化合物,氨水是氨的水溶液是混合物,故B错误;
C.弱碱盐水解生成难挥发性强酸时,加热蒸干仍得到原物质,FeCl3溶液加热蒸干、灼烧得到Fe2O3,Fe2(SO4)3溶液加热蒸干、灼烧得到Fe2(SO4)3,故C错误;
D.升高温度化学平衡常数可能增大也可能减小,若为放热反应,升高温度平衡逆移,平衡常数减小,若为吸热反应,升高温度平衡正移,则平衡常数增大,而电离平衡、水解平衡中,平衡常数都随温度的升高而增大,故D错误.
故选A.
点评:本题考查了反应自发性的判断、弱电解质、盐的水解、平衡常数的影响因素,题目涉及的知识点较多,侧重于基础知识的综合考查,题目难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
下列可逆反应达到平衡后,增大压强同时降低温度,平衡一定向右移动的是( )
| A、2AB(g)?A2(g)+B2(g)△H>0 |
| B、A2(g)+3B2(g)?2AB3(g)△H<0 |
| C、A(s)+B(g)?C(g)+D(g)△H>0 |
| D、2A(g)+B(g)?3C(g)+D(s)△H<0 |
下列化学式与指定物质的主要成分对应正确的是( )
| A、CH4--天然气 |
| B、CO2--水煤气 |
| C、CuSO4?5H2O--明矾 |
| D、NaHCO3--苏打粉 |
上海环保部门为了使城市生活垃圾得到合理利用,近年来逐步实施了生活垃圾分类投放的办法.其中塑料袋、废纸、旧橡胶制品等属于( )
| A、无机物 | B、有机物 |
| C、盐类 | D、非金属 |
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )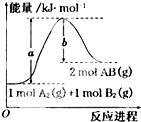

| A、每生成2分子AB吸收bkJ热量 |
| B、加入催化剂,该化学反应的反应热变大 |
| C、断裂1molA-A和1molB-B键,放出akJ能量 |
| D、该反应热△H=+(a-b)kJ/mol |
分液漏斗是把密度不同且互不相溶的液体分离的仪器.下列各组物质中,能用分液漏斗进行分离的是( )
| A、四氯化碳和液溴 |
| B、汽油和花生油 |
| C、花生油和水 |
| D、酒精和水 |
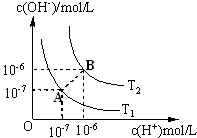 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.