题目内容
9.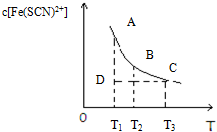 氯化铁和硫氰化钾在溶液中存在下列平衡:Fe3+(aq)+3SCN-(aq)?Fe(SCN)3(aq),某氯化铁和硫氰化钾的混合溶液中,Fe(SCN)3的物质的量浓度与温度T的关系如图所示(曲线上任何一点都表示平衡状态),下列说法不正确的是( )
氯化铁和硫氰化钾在溶液中存在下列平衡:Fe3+(aq)+3SCN-(aq)?Fe(SCN)3(aq),某氯化铁和硫氰化钾的混合溶液中,Fe(SCN)3的物质的量浓度与温度T的关系如图所示(曲线上任何一点都表示平衡状态),下列说法不正确的是( )| A. | FeCl3(aq)与KSCN(aq)反应的热化学反应方程式为:Fe3+(aq)+SCN-(aq)=Fe(SCN)3+(aq)△H>0 | |
| B. | 温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 反应处于D点时,一定有V正>V逆 | |
| D. | A点与B点相比,A点的c(Fe3)+大 |
分析 图象中曲线上的A、B、C三点为不同温度下的平衡状态,D在曲线下方,不是平衡状态,c[Fe(SCN)2+]比平衡状态小,应向正反应方向移动,随着温度的升高c[Fe(SCN)2+]逐渐减小,说明反应放热,升高温度平衡向逆反应方向移动.
解答 解:A.随着温度的升高c[Fe(SCN)2+]逐渐减小,说明反应放热,△H<0,故A错误;
B.反应放热,升高温度平衡向逆反应方向移动,则k减小,所以温度为T1<T2时,反应的平衡常数分别为K1、K2,则K1>K2,故B错误;
C.D在曲线下方,不是平衡状态,c[Fe(SCN)2+]比平衡状态小,应向正反应方向移动,V正>V逆,故C正确;
D.由图象可知,A点c[Fe(SCN)2+]较大,则c(Fe3+)应较小,故D错误.
故选C.
点评 本题考查化学平衡图象问题,题目难度中等,本题注意分析图象中曲线的变化特征,把握温度对平衡移动的影响,此为解答该题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列说法正确的是( )
| A. | 两种不同元素的原子中,137Cs比131I多6个中子 | |
| B. | 多电子原子中,在离核较远的区域内运动的电子能量较低 | |
| C. | 同主族元素的简单阴离子还原性越强,其氢化物的稳定性越强 | |
| D. | 短周期元素X和Y的原子序数相差2,则X与Y可能同周期,也可能同主族 |
20.如表有关除去杂质(括号内为杂质)的方法和试剂都正确的是( )
| 物质 | 方法 | 试剂 | |
| A | CO2(SO2) | 洗气 | 氢氧化钠溶液 |
| B | 氯化亚铁溶液(氯化铁) | 过滤 | 铁粉 |
| C | 水(溴) | 萃取、分液 | 酒精 |
| D | 硫酸钠(氯化铵) | 加热 | 氢氧化钠 |
| A. | A | B. | B | C. | C | D. | D |
17.SO2与H2S混合生成S和H20,下列说法正确的是( )
| A. | SO2的排放是造成酸雨的唯一原因 | |
| B. | 该反应说明S02具有还原性 | |
| C. | 自然界不存在单质形式的硫 | |
| D. | 在该反应条件下,H2S的还原性强于S的还原性 |
4.用离子交换法从废钒催化剂(含有V2O5、VOSO4及不溶性残渣)中回收钒工艺的主要流程如图1:

部分含钒物质在水中的溶解性如表:
回答下列问题:
(1)滤液中含钒的主要成分为VOSO4 (填化学式).
(2)反应①的离子方程式为V2O5+SO32-+4H+═VO2++SO42-+2H2O
(3)反应②中1mo1KClO3参加反应,电子转移的数目为6mol
(4)反应③的离子方程为NH4++VO3-=NH4VO3↓,该反应沉钒率的高低除受溶液pH影响外,还需要控制温度.根据图2判断最佳温度为80℃
(5)工业由V2O5,冶炼金属钒常用铝热剂法,该反应的化学方程为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.

部分含钒物质在水中的溶解性如表:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)滤液中含钒的主要成分为VOSO4 (填化学式).
(2)反应①的离子方程式为V2O5+SO32-+4H+═VO2++SO42-+2H2O
(3)反应②中1mo1KClO3参加反应,电子转移的数目为6mol
(4)反应③的离子方程为NH4++VO3-=NH4VO3↓,该反应沉钒率的高低除受溶液pH影响外,还需要控制温度.根据图2判断最佳温度为80℃
(5)工业由V2O5,冶炼金属钒常用铝热剂法,该反应的化学方程为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.
14.已知碳酸氢钾溶液显碱性,25℃时向10mL0.01mol/LKHCO3溶液中滴加0.01mol/LKOH溶液,随着KOH溶液体积的增加,溶液中微粒浓度关系正确的是( )
| A. | V(KOH)=0时,溶液中c(K+)=c(HCO3-)+c(H2CO3) | |
| B. | V(KOH)=10mL时,溶液中c(HCO3-)>c(H2CO3) | |
| C. | V(KOH)=20mL时,溶液中c(K+)>c(CO32-)>c(OH-)>c(H+) | |
| D. | 对V(KOH)=10mL时的溶液升温,溶液中:c(K+)>c(OH-)>c(CO32-)>c(H+) |
1.在无色强酸性溶液中,下列各组离子能够大量共存的是( )
| A. | Cl-、Na+、NO3-、Ca2+ | B. | MnO4-、HCO3-、Cl-、K+ | ||
| C. | K+、Ba2+、Cl-、SO42- | D. | K+、Mg2+、NO3-、I- |
18.A1、Fe、Cu都是重要而常见的金属,下列有关说法正确的是( )
| A. | 三者的单质在常温下都不溶于浓硫酸和浓硝酸,是因发生了钝化现象 | |
| B. | 三者的单质放置在空气中均只生成氧化物 | |
| C. | 三者所对应的氢氧化物在水中不都存在溶解平衡 | |
| D. | 工业上制备这三种金属的方法依次为电解法、热还原法和热还原法 |
19.下列物质的电离方程式正确的是( )
| A. | H2CO3?2H++CO32- | B. | HClO═H++ClO- | ||
| C. | NaHCO3=Na++H++CO32- | D. | Ba(OH)2═Ba2++2OH- |