题目内容
6.鉴别CO2和SO2的下列方法中正确的是( )| A. | 将气体通入澄清石灰水 | B. | 将气体通入到氢氧化钠溶液中 | ||
| C. | 将气体通入到石蕊溶液中 | D. | 将气体通入到酸性高锰酸钾溶液中 |
分析 CO2和SO2均为酸性氧化物,但SO2具有还原性,以此来解答.
解答 解:A.二者均使石灰水变浑浊,不能鉴别,故A不选;
B.二者均与NaOH反应生成可溶性盐和水,现象相同,不能鉴别,故B不选;
C.二者均使石蕊溶液变红,现象相同,不能鉴别,故C不选;
D.SO2使高锰酸钾褪色,而CO2不能,故D选;
故选D.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物的性质,题目难度不大.

练习册系列答案
相关题目
16.如图有关实验原理、装置、操作或结论的描述中,不正确的是(有关装置中的夹持仪器略去未画)( )
| A. |  实验室用大理石与盐酸制取CO2 | B. |  制取SO2、检验SO2的漂白性 | ||
| C. | 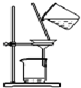 分离硫酸铜晶体 | D. | 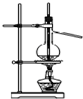 分离乙醇和水 |
17.现有铁和铜组成的合金共a mol,其中Cu的物质的量分数为x,研成粉末状后全部投入含bmol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO.试回答下列问题:
(1)随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有六种情况,请用粒子符号填写下列表1空白:
(2)若残留固体只有铜时,则溶液中可能存在的金属离子为(填粒子符号)Fe2+或Fe2+、Cu2+;
若合金全部溶解,则溶液中可能存在的金属离子为(填粒子符号)Fe2+、Cu2+或Fe3+、Fe2+、Cu2+或Fe3+、Cu2+;
(3)当溶液中金属离子只有Fe2+、Cu2+时,b的取值范围(用a,x表示)$\frac{8}{3}$a≥b>$\frac{8}{3}$a(1-x);
(4)当x=0.5,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生672mLNO.
则a=0.04,b=0.12.
(1)随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有六种情况,请用粒子符号填写下列表1空白:
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 溶液中的金属离子 | Fe2+ | Fe2+、Cu2+ | Cu2+、Fe3+ | |||
| 残留固体成分 | Fe、Cu | Cu |
若合金全部溶解,则溶液中可能存在的金属离子为(填粒子符号)Fe2+、Cu2+或Fe3+、Fe2+、Cu2+或Fe3+、Cu2+;
(3)当溶液中金属离子只有Fe2+、Cu2+时,b的取值范围(用a,x表示)$\frac{8}{3}$a≥b>$\frac{8}{3}$a(1-x);
(4)当x=0.5,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生672mLNO.
则a=0.04,b=0.12.
14.下列说法正确的是( )
| A. | 用托盘天平称量时,所称药品均放在纸上,并置于托盘天平的左盘 | |
| B. | 分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 | |
| C. | 用最小刻度为0.1mL的量筒量取8.85mL的液体 | |
| D. | 给试管里的液体加热时,试管外壁应干燥,试管口应向上倾斜 | |
| E. | 浓硝酸与浓盐酸均易挥发,故都必须保存在棕色试剂瓶中,并置于阴凉处. |
11.某无色溶液与NH4HCO3作用能产生气体,则此溶液中可能大量共存的离子组是( )
| A. | Cl-、Mg2+、H+、K+ | B. | Na+、Ba2+、OH-、SO42- | ||
| C. | Ag+、K+、Cl-、SO42一 | D. | MnO4-、NO3-、SO42-、Na+ |
18.①钠比水要轻;②钠的熔点比较低;③钠与水反应时要放出热量;④钠与水反应后溶液呈碱性;⑤钠是活泼金属.某学生将一小块金属钠投入到滴有酚酞的水中,该实验能证明上述五点性质中的( )
| A. | 仅①④⑤ | B. | 仅①②④ | C. | 仅①③④⑤ | D. | ①②③④⑤ |
15.下列说法中错误的是( )
| A. | 原子、分子、离子都可以构成物质 | |
| B. | 由同种元素构成的物质是纯净物 | |
| C. | 盐酸与氢氧化钠反应一定是复分解反应 | |
| D. | 置换反应中一定有单质生成 |