题目内容
20.下列叙述中正确的是( )| A. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| B. | 凡质子数相同的微粒,其化学性质一定相同 | |
| C. | 含氧酸可作氧化剂,无氧酸只作还原剂 | |
| D. | 元素的非金属性越强,其简单阴离子的还原性越弱 |
分析 A、单原子形成的离子不一定具有稀有气体原子的核外电子排布;
B、质子数相同的粒子的化学性质不一定相同;
C、无氧酸电离氢离子可作氧化剂;
D、元素的非金属性越强,得电子能力越强,得电子后的离子失电子能力越弱,则简单阴离子的还原性越弱.
解答 解:A、单原子形成的离子不一定具有稀有气体原子的核外电子排布,如H+,故A错误;
B、质子数相同的粒子的化学性质不一定相同,如钠原子和钠离子,质子数相同,钠原子性质活泼,钠离子性质稳定,故B错误;
C、无氧酸电离氢离子可作氧化剂,如铁和盐酸反应生成氢气,盐酸是氧化剂,故C错误;
D、元素的非金属性越强,得电子能力越强,得电子后的离子失电子能力越弱,则简单阴离子的还原性越弱,故D正确;
故选D.
点评 本题考查元素性质递变规律,侧重考查元素周期律知识,明确元素周期律内涵是解本题关键,注意规律中的异常现象,异常现象是A.

练习册系列答案
相关题目
11.下列解释事实的化学方程式或离子方程式不正确的是( )
| A. | 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2═I2+2H2O | |
| B. | 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2++SO42-+PbS═CuS+PbSO4 | |
| C. | 在燃煤时加入适量石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO3+2CO2 | |
| D. | 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3+Na2SO4 |
8.下列离子方程式书写正确的是( )
| A. | 氢氧化铁溶于氢碘酸中$Fe{(OH)_3}+3{H^+}=F{e^{3+}}+3{H_2}O$ | |
| B. | 次氯酸钙溶液中通入过量的二氧化碳Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | |
| C. | 向100mL 0.1moL/L的溴化亚铁溶液中通入0.015 mol的氯气$2F{e^{2+}}+4B{r^-}+3C{l_2}=2F{e^{3+}}+2B{r_2}+6C{l^-}$ | |
| D. | 向明矾溶液逐滴加入氢氧化钡溶液至铝离子刚好完全沉淀$A{l^{3+}}+S{O_4}^{2-}+B{a^{2+}}+3O{H^-}=BaS{O_4}↓+Al{(OH)_3}↓$ |
15.废水中CrO42-浓度降至5.0×10-7mol•L-1以下才能排放.含CrO42-的废水可用沉淀法处理:加入可溶性钡盐生成BaCrO4沉淀,再加入可溶性硫酸盐处理多余的Ba2+.加入可溶性钡盐后的废水中Ba2+的浓度应不小于(已知:Ksp(BaCrO4)=1.2×10-10)( )
| A. | 1.2×10-5 mol•L-1 | B. | 2.4×10-4 mol•L-1 | ||
| C. | 3.6×10-4 mol•L-1 | D. | 4.8×10-4 mol•L-1 |
5.下列变化过程与能量的说法中正确的是( )
| A. | 中和反应是吸热反应 | |
| B. | 燃烧属于放热反应 | |
| C. | 化学键断裂放出能量 | |
| D. | 吸热反应中,反应物总能量大于生成物总能量 |
12.各取1mol 下列物质与溴水充分反应,消耗Br2的物质的量按①②顺序排列正确的是( )
①漆酚: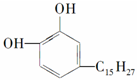 ②白藜芦醇
②白藜芦醇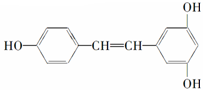
①漆酚:
 ②白藜芦醇
②白藜芦醇
| A. | 2mol、6mol | B. | 5mol、6mol | C. | 4mol、5mol | D. | 3mol、6mol |
9.以下物质:(1)甲烷;(2)苯;(3)聚乙烯;(4)2-丁炔;(5)环己烷;(6)邻二甲苯;(7)苯乙烯.既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的是( )
| A. | (3)(4)(5) | B. | (4)(5)(7) | C. | (4)(7) | D. | (3)(4)(5)(7) |
10.下列关于SiO2和金刚石的叙述正确的是( )
| A. | SiO2晶体结构中,每个Si原子与2个O原子直接相连 | |
| B. | 通常状况下,60gSiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数) | |
| C. | 12g金刚石含4molC-C键 | |
| D. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 |