题目内容
(10分)四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。请回答下列问题:
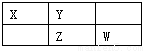
(1)元素Z位于周期表中第_______周期,_______ 族;
(2)这些元素的氢化物中,水溶液碱性最强的是_______________(写化学式);
(3)XW2的电子式为_______________
(4)Y的最高价氧化物的水化物与其氢化物反应的离子方程式 。
(1)三,VA族;(2)NH3;(3) (4)H+ + NH3 === NH4+
(4)H+ + NH3 === NH4+
【解析】
试题解析:由短周期元素在周期表中的位置可知,X、Y处于第二周期,Z、Y处于第三周期,Z元素原子核外电子总数是其最外层电子数的3倍,令最外层电子数为a,则2+8+a=3a,解得a=2,则Z为P元素,故X为C、Y为N、W为S。(1)Z为P元素,处于第三周期ⅤA族;(2)这些元素的氢化物中,水溶液碱性最强的是NH3;(3)CS2中C原子与S原子之间形成2对共用电子对,其电子式为 ;(4)N的最高价为+5,最高价氧化物的水化物是HNO3,氰化物是NH3,两者反应的离子方程式是:H+ + NH3 =NH4+。
;(4)N的最高价为+5,最高价氧化物的水化物是HNO3,氰化物是NH3,两者反应的离子方程式是:H+ + NH3 =NH4+。

 习题精选系列答案
习题精选系列答案某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应A(g)+B(g)  C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.反应在前5 s的平均速率v(A)=0.17 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH>0
C.相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆)
 CH3OH(g)+H2O(g),△H=-akJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),△H=-akJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
 增大的是________(选填编号)。
增大的是________(选填编号)。
 ,可发生硝化反应,则产生的一硝基化合物可能有
,可发生硝化反应,则产生的一硝基化合物可能有