题目内容
16.在AlCl3溶液中存在着平衡体系:Al3+3H2O?Al(OH)3+3H+,改变条件,填写表(填“增大”、“减小”或“不变”及“向左”、“向右”或“不移动”)| 平衡移动方向 | C(Al3+) | n(H+) | c(H+) | |
| 通入HCl | ||||
| 加少量NaOH | ||||
| 加少量Na2CO3 | ||||
| 加水稀释 | ||||
| 升高温度 |
分析 在AlCl3溶液中存在着平衡体系:Al3+3H2O?Al(OH)3+3H+.
通入HCl,增大了c(H+),平衡左移,据此分析;
加少量NaOH,使c(H+)减小,平衡右移,据此分析;
加少量Na2CO3,反应掉了H+,使c(H+)减小,平衡右移,据此分析;
盐越稀越水解,即加水促进盐的水解;
盐的水解吸热.
解答 解:在AlCl3溶液中存在着平衡体系:Al3+3H2O?Al(OH)3+3H+.
通入HCl,增大了c(H+),平衡左移,n(H+)增大,C(Al3+)增大;
加少量NaOH,使c(H+)减小,平衡右移,n(H+)减小,C(Al3+)减小;
加少量Na2CO3,反应掉了H+,使c(H+)减小,平衡右移,n(H+)减小,C(Al3+)减小;
盐越稀越水解,即加水促进盐的水解,即平衡右移,n(H+)增大,但由于加水导致溶液体积增大,故c(H+)减小,C(Al3+)减小;
盐的水解吸热,故升高温度,平衡右移,水解出的n(H+)增大,c(H+)增大,C(Al3+)减小.
故答案为:
| 平衡移动方向 | C(Al3+) | n(H+) | c(H+) | |
| 通入HCl | 向左 | 增大 | 增大 | 增大 |
| 加少量NaOH | 向右 | 减小 | 减小 | 减小 |
| 加少量Na2CO3 | 向右 | 减小 | 减小 | 减小 |
| 加水稀释 | 向右 | 减小 | 增大 | 减小 |
| 升高温度 | 向右 | 减小 | 增大 | 增大 |
点评 本题考查盐类水解平衡的移动,注意根据平衡移动和溶液体积的变化来分析溶液中离子浓度变化,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列叙述一定正确的是( )
| A. | 将wg a%的NaCl溶液蒸发掉w/2g水,得到2a%的NaCl溶液 | |
| B. | 将25g无水CuSO4溶于水制成100mL溶液,其浓度为1mol/L | |
| C. | 将1体积c1mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2c1mol/L | |
| D. | 将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液 |
11. 用NaOH溶液滴定10mL盐酸,滴定过程中溶液的pH变化如图.NaOH溶液和盐酸的物质的量浓度(单位:mol•L-1)分别为( )
用NaOH溶液滴定10mL盐酸,滴定过程中溶液的pH变化如图.NaOH溶液和盐酸的物质的量浓度(单位:mol•L-1)分别为( )
 用NaOH溶液滴定10mL盐酸,滴定过程中溶液的pH变化如图.NaOH溶液和盐酸的物质的量浓度(单位:mol•L-1)分别为( )
用NaOH溶液滴定10mL盐酸,滴定过程中溶液的pH变化如图.NaOH溶液和盐酸的物质的量浓度(单位:mol•L-1)分别为( )| A. | 0.12,0.04 | B. | 0.04,0.12 | C. | 0.12,0.06 | D. | 0.03,0.09 |
1.某混合物含有氯化钠、碳酸钠和氯化钾.经分析知其中氯的质量分数为35.5%,则该混合物中碳酸钠的质量分数可能为( )
| A. | 20% | B. | 30% | C. | 45% | D. | 55% |
1.(1)实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$ TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:

有关物质的性质如下表:
仪器A的名称是干燥管.装置E中的试剂是浓硫酸.反应开始前依次进行如下操作:
组装仪器、检验装置气密性、加装药品,通N2一段时间后点燃酒精灯.反应结束后的操作包括:
①停止通N2②熄灭酒精灯③冷却至室温.正确的顺序为②③①(填序号).欲分离D中的液态混合物,所采用操作的名称是蒸馏.

有关物质的性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
组装仪器、检验装置气密性、加装药品,通N2一段时间后点燃酒精灯.反应结束后的操作包括:
①停止通N2②熄灭酒精灯③冷却至室温.正确的顺序为②③①(填序号).欲分离D中的液态混合物,所采用操作的名称是蒸馏.
19.一定条件下,在2L密闭容器中发生反应:N2+3H2$?_{催化剂}^{高温、高压}$2NH3,测得1min内,H2的物质的量由3mol减少到1.2mol,则1min内NH3的化学反应速率为( )
| A. | 0.6 mol•L-1•min-1 | B. | 0.9 mol•L-1•min-1 | ||
| C. | 1.2 mol•L-1•min-1 | D. | 1.8 mol•L-1•min-1 |


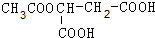 +H2O.
+H2O.