题目内容
17.在某温度下,将H2和I2各1mol的气态混合物充入1L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.5mol•L-1,则:(1)该反应的平衡常数K=4(填写数值)
(2)在上述温度下,该容器中若通入H2和I2各0.20mol的气态混合物,求达到化学平衡状态时,下列各物质的浓度:[H2]=0.1mol•L-1,[HI]=0.2mol•L-1,此时该平衡混合气体中,H2的体积分数为25%,平衡时H2的转化率为50%.
(3)该反应是放热反应,若升温,则平衡常数K将变小(填“变大”“变小”“不变”).
分析 (1)在某温度下,将H2和I2各0.1mol的气态混合物充入1L的密闭容器中,达到平衡时,测得c(H2)=0.5mol/L,则
H2(g)+I2(g)  2HI(g)
2HI(g)
起始时各物质的浓度(mol•L-1) 1 1 0
各物质的浓度变化量(mol•L-1) 0.5 0.5 1
平衡时各物质的浓度(mol•L-1) 0.5 0.5 1
利用平衡的浓度计算K,K为生成物浓度幂之积与反应物浓度幂之积的比;
(2)设转化的氢气为x,利用三段法得出各物质的平衡浓度,平衡常数与(1)相同,以此来计算;
(3)该反应是放热反应,若升温,平衡逆向移动,据此判断平衡常数的变化;
解答 解:(1)在某温度下,将H2和I2各0.1mol的气态混合物充入1L的密闭容器中,达到平衡时,测得c(H2)=0.5mol/L,则
H2(g)+I2(g)  2HI(g)
2HI(g)
起始时各物质的浓度(mol•L-1) 1 1 0
各物质的浓度变化量(mol•L-1) 0.5 0.5 1
平衡时各物质的浓度(mol•L-1) 0.5 0.5 1
所以K=$\frac{c{\;}^{2}(HI)}{c(H{\;}_{2})•c(I{\;}_{2})}$=$\frac{{1}^{2}}{0.5×0.5}$=4,
故答案为:4;
(2)设转化的氢气为xmol•L-1,利用三段法分析
H2(g)+I2(g)  2HI(g)
2HI(g)
起始时各物质的浓度(mol•L-1) 0.2 0.2 0
各物质的浓度变化量(mol•L-1) x x 2x
平衡时各物质的浓度(mol•L-1) 0.2-x 0.2-x 2x
平衡常数与(1)相同,所以有$\frac{(2x)^{2}}{(0.2-x)(0.2-x)}$=4,解得x=0.1,
所以平衡时[H2]=(0.2-x)mol•L-1=0.1mol•L-1,[HI]=0.2mol•L-1,H2的体积分数为$\frac{0.1}{0.2+0.2}$×100%=25%,平衡时H2的转化率为$\frac{0.1}{0.2}$×100%=50%,
故答案为:0.1;0.2;25%;50%.
(3)该反应是放热反应,若升温,平衡逆向移动,所以平衡常数变小,
故答案为:变小.
点评 本题考查了化学平衡的三段式计算应用,平衡常数的计算分析应用,注意反应前后气体体积不变,同比例增大反应物的量平衡不动,平衡原平衡是等效平衡,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 摩尔质量:g | B. | 物质的量浓度:L/mol | ||
| C. | 物质的量:mol | D. | 气体摩尔体积:L |
| A. | N2、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| B. | 向AlCl3溶液中滴加过量的氨水能看到先产生白色沉淀,后沉淀溶解 | |
| C. | 可用浓硫酸或者浓硝酸除去镀在铝表面的铜镀层 | |
| D. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解 |
| A. | 过氧化钠可用作漂白剂和呼吸面具中的供氧剂 | |
| B. | 钠和钾的合金常温下是固体,可用于快中子反应堆作热交换剂 | |
| C. | 碳酸氢钠是焙制糕点所用的发酵粉之一,也可以用于治疗胃酸过多 | |
| D. | 热的碳酸钠溶液可以去除物品表面的油污 |
| A. | c(CN-)<c(HCN) | B. | c(HCN)+c(CN-)═0.04 mol/L | ||
| C. | c(OH-)═c(H+)+c(HCN) | D. | c(Na+)>c(CN-)>c(H+)>c(OH-) |
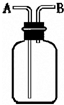 如图所示装置有多种用途,请回答下列问题:
如图所示装置有多种用途,请回答下列问题: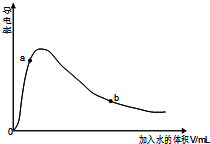 醋酸是中学常用的一种弱酸.
醋酸是中学常用的一种弱酸.