题目内容
3.用于笔记本电脑的甲醇(CH3OH)燃料电池,质子交换膜左右两侧的溶液均为500mL 2mol/LH2SO4溶液,当电池中有1mol e-发生转移时,左右两侧溶液的质量之差为12g(忽略气体的溶解,假设反应物完全耗尽).分析 负极反应式为CH3OH-6e-+H2O=CO2+6H+,正极反应式为O2+4H++4e-=2H2O,按照电极反应式计算.
解答 解:负极反应式为CH3OH-6e-+H2O=CO2+6H+,当转移1mol电子时,左侧质量减轻$\frac{1}{6}$×12g=2g,还要有1molH+通过质子交换膜进入右侧,质量减少1g,正极反应式为O2+4H++4e-=2H2O,右侧质量增加32g×$\frac{1}{4}$=8g,加上转移过来的1gH+,因此左右两侧溶液的质量之差为8g+1g+2g+1g=12g,
故答案为:12g.
点评 本题考查电化学知识,注重学生的分析能力和计算能力,把握电极方程式的书写,注意质子交换膜的性质是关键,难度中等.

练习册系列答案
相关题目
13.有关阿佛加德罗常数(NA),下列说法中正确的是( )
| A. | 1 mol SiO2晶体中,含有2NA个Si-O共价键 | |
| B. | 常温下,4.4 g CO2和N2O混合物中所含有的原子数为0.3 NA | |
| C. | 0.2 mol Cl2与足量的铁粉充分反应,转移电子数为0.6NA | |
| D. | 标准状况下,11.2 L 氯仿所含分子数为0.5 NA |
14.依据反应原理回答下列问题:
Ⅰ.请你利用原电池原理,设计实验,比较铜和铁的金属活动性.
实验用品:铁片、铜片、导线、金属夹、小灯泡、硫酸亚铁溶液、硫酸铜溶液、500mL烧杯.
画出实验装置简图,并标出正负极、电子流动方向.
Ⅱ.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
(1)过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑.
(2)实验①的目的是研究温度对H2O2分解速率的影响.
实验中滴加FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图2所示,则A、B、C三点所表示的瞬时反应速率最慢的是C.
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图3甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察溶液中气泡产生的速率,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是排除氯离子的干扰.
②定量分析:用图3乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是收集40mL气体所需的时间.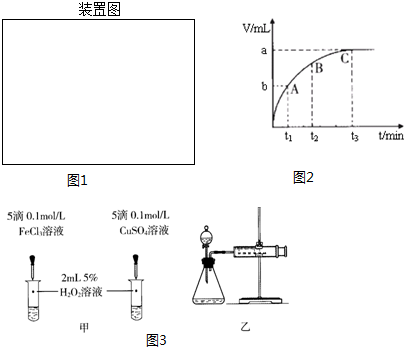
Ⅰ.请你利用原电池原理,设计实验,比较铜和铁的金属活动性.
实验用品:铁片、铜片、导线、金属夹、小灯泡、硫酸亚铁溶液、硫酸铜溶液、500mL烧杯.
画出实验装置简图,并标出正负极、电子流动方向.
Ⅱ.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入3mL 5% H2O2溶液,各滴入2滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入3mL 5% H2O2溶液和3mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
(2)实验①的目的是研究温度对H2O2分解速率的影响.
实验中滴加FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图2所示,则A、B、C三点所表示的瞬时反应速率最慢的是C.
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图3甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察溶液中气泡产生的速率,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是排除氯离子的干扰.
②定量分析:用图3乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是收集40mL气体所需的时间.

11.水杨酸环已酯具有花香气味,可作为香精配方.其合成路线如下:
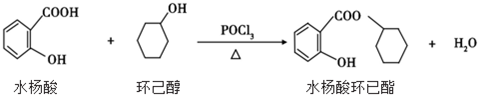
下列说法正确的是( )

下列说法正确的是( )
| A. | 水杨酸的核磁共振氢谱有 4 个吸收峰 | |
| B. | 水杨酸、环已醇和水杨酸环已酯都能与 FeCl3 溶液发生显色反应 | |
| C. | 1mol 水杨酸跟浓溴水反应时,最多消耗 2molBr2 | |
| D. | 1mol 水杨酸环已酯在 NaOH 溶液中水解时,最多消耗 3molNaOH |
8.下列离子方程式书写正确的是( )
| A. | 制取Fe(OH)3胶体:Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 锅炉除水垢时先用纯碱浸泡:CaSO4+CO32-═CaCO3+SO42- | |
| C. | 泡沫灭火器灭火原理:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ | |
| D. | 向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O═CO32-+2C6H5OH |
12.下列各组物质中,最难发生化学反应的是( )
| A. | H2SO4和Ba(OH)2 | B. | CO2和NaOH | C. | CaCO3和HCl | D. | Mg(OH)2和CuSO4 |
13.下列装置都可制取HCl气体,其中药品选用错误的是( )
| A. |  | B. |  | C. |  | D. |  |