题目内容
5.下列实验方案能达到相应实验目的是( )| 选项 | 实验目的 | 方案 |
| A | 除去乙酸乙酯中的乙酸 | 用NaOH溶液洗涤,分液,然后干燥 |
| B | 制备少量漂白粉 | Cl2通人澄清石灰水中,然后蒸发结晶 |
| C | 检验食盐中是否添加KIO3 | 食盐溶解,然后加入淀粉溶液 |
| D | 测定醋酸溶液浓度 | 酚酞作指示剂,用标准NaOH溶液滴定 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙酸乙酯在NaOH溶液中易水解;
B.氯气与石灰乳反应制备漂白粉;
C.KIO3不能使淀粉变蓝色;
D.醋酸与NaOH恰好反应生成醋酸钠显碱性,选择在碱性条件下变色的指示剂.
解答 解:A.乙酸乙酯在NaOH溶液中易水解,所以除去乙酸乙酯中的乙酸应该选择饱和碳酸钠溶液,故A错误;
B.氯气与石灰乳反应制备漂白粉,澄清石灰水中氢氧化钙的浓度太小,故B错误;
C.KIO3不能使淀粉变蓝色,所以在食盐溶液中加淀粉不会变色,不能检验是否含有碘酸钾,故C错误;
D.醋酸与NaOH恰好反应生成醋酸钠显碱性,选择在碱性条件下变色的指示剂,所以用NaOH滴定醋酸时选用酚酞作指示剂,故D正确.
故选D.
点评 本题考查化学实验方案的评价,涉及物质的检验、物质的制备、酯的水解以及指示剂等,把握实验操作的规范性、实验细节和实验原理为解答的关键,注意方案的合理性、评价性、操作性分析,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
13.铜粉放入稀硫酸溶液中,加热后无明显现象发生,当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出.该盐是( )
| A. | KNO3 | B. | NaCl | C. | Na2CO3 | D. | FeSO4 |
20.一种新药物结构如图所示,下列有关说法正确的是( )
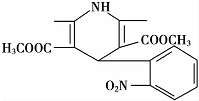

| A. | 该化合物的分子式为C17H17N2O6 | |
| B. | 该化合物的分子中含有三种不同的官能团 | |
| C. | 该化合物能与氢气发生加成反应,但不能与溴的四氯化碳溶液反应 | |
| D. | 该化合物能发生水解反应、聚合反应、取代反应 |
10.下列叙述和离子方程式都正确的是( )
| A. | 向一定量的Al2(SO4)3溶液中逐滴加入氨水至过量,反应的离子方程式是Al3++4OH-=AlO2-+2H2O | |
| B. | 向一定量的NaHCO3溶液中加入足量的澄清石灰水,产生白色沉淀,反应的离子方程式是 Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 向适量某溶液中滴入KSCN溶液,溶液变为红色,则该溶液中一定存在Fe3+而不存在Fe2+ | |
| D. | 高锰酸钾酸化要用硫酸而不能用盐酸,其原因是用盐酸酸化会发生反应:10Cl-+2MnO4-+16H+=5Cl2↑+2Mn2++8H2O |
17.用下列装置进行实验,能达到相应实验目的是( )
| A. | 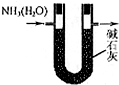 用如图装置干燥氨气 | |
| B. | 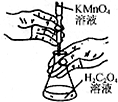 用如图装置进行高锰酸钾溶液滴定草酸溶液实验 | |
| C. | 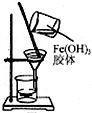 用如图装置可分离氢氧化铁胶体中Fe(OH)3和水 | |
| D. |  用如图装置可验证酸性:盐酸>碳酸>苯酚 |
14.某校化学实验兴趣小组在“探究溴水与氯化亚铁溶液反应”的实验中发现:在足量的稀氯化亚铁溶液中,加入1-2滴溴水,振荡后溶液呈黄色.查阅资料显示:溴水是溴(Br2)的水溶液,呈黄色;溴水中含有溴单质.
(1)提出问题:Fe3+、Br2,谁的氧化性更强.
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2 (填化学式,下同)所致
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+ 所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.除氯化亚铁溶液和溴水外,还有供选用的试剂:
a、酚酞试液;b、CCl4;c、无水酒精;d、KSCN溶液.
请你在下表中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)
(4)结论:氧化性:Br2>Fe3+.故在足量的稀氯化亚铁溶液中,加入1-2滴溴水,溶液呈黄色所发生的离子反应方程式为2Fe2++Br2═2Fe3++2Br-
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是Fe2+ (填离子的化学式).
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1mol/L.
(1)提出问题:Fe3+、Br2,谁的氧化性更强.
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2 (填化学式,下同)所致
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+ 所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.除氯化亚铁溶液和溴水外,还有供选用的试剂:
a、酚酞试液;b、CCl4;c、无水酒精;d、KSCN溶液.
请你在下表中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是Fe2+ (填离子的化学式).
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1mol/L.
15.有机物  苯环上的四溴取代物同分异构体有( )
苯环上的四溴取代物同分异构体有( )
 苯环上的四溴取代物同分异构体有( )
苯环上的四溴取代物同分异构体有( )| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |