题目内容
13.铜粉放入稀硫酸溶液中,加热后无明显现象发生,当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出.该盐是( )| A. | KNO3 | B. | NaCl | C. | Na2CO3 | D. | FeSO4 |
分析 Cu与稀硫酸不反应,硝酸盐在酸性条件下具有硝酸的强氧化性,则可使Cu溶解,同时生成NO气体,据此对各选项进行判断.
解答 解:A.Cu、稀硫酸、KNO3混合时发生3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,则铜粉质量减轻,同时溶液逐渐变为蓝色,且有气体逸出,故A正确;
B.Cu、稀硫酸、NaCl混合时,不会发生反应,故B错误;
C.Cu与稀硫酸不反应,加入Na2CO3时与酸反应生成二氧化碳气体,但Cu不溶解,故C错误;
D.Cu、稀硫酸、FeSO4混合时不发生反应,故D错误;
故选A.
点评 本题考查铜及硝酸盐在酸性条件下的性质,题目难度不大,明确常见物质性质为解答关键,注意硝酸根离子在酸性条件下具有强氧化性,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
3.表是部分元素在周期表的位置,表中列有①~⑩中元素,用元素符号或化学式填空回答
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为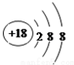
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(3)写出⑤的最高价氧化物对应水化物与氢氧化钠溶液反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)某元素R的气态氢化物为HXR,且R在该氢化物中的质量分数为94%,8.5g的HXR气体在标准状态下的体积是5.6L.则HXR的相对分子量为34;HXR的化学式为H2S.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(3)写出⑤的最高价氧化物对应水化物与氢氧化钠溶液反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)某元素R的气态氢化物为HXR,且R在该氢化物中的质量分数为94%,8.5g的HXR气体在标准状态下的体积是5.6L.则HXR的相对分子量为34;HXR的化学式为H2S.
4.下列离子方程式书写正确的是( )
| A. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2 Ba2++4OH-=AlO2-+2BaSO4↓+2H2O | |
| B. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| C. | 向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3•H2O | |
| D. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O |
1.氮的固定是几百年来科学家一直研究的课题.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应
②分析数据可知:人类不适合大规模模拟大气固氮原因K值小,正向进行的程度小(或转化率低),不适合大规模生产
③从平衡角度考虑.工业固氮应该选择常温条件,但实际工业产生却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适
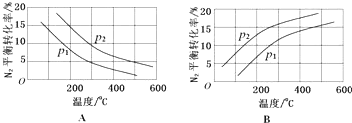
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1.
(3)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知:人类不适合大规模模拟大气固氮原因K值小,正向进行的程度小(或转化率低),不适合大规模生产
③从平衡角度考虑.工业固氮应该选择常温条件,但实际工业产生却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1.

(3)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1.
18.下列各组离子或分子能大量共存,当加入相应试剂后,发生反应的离子方程式书写正确的是( )
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3•H2O |
| B | Na+、OH-、Cl- | 少量Mg(HCO3)2溶液 | Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32- |
| C | K+、NH3•H2O、CO32- | 通入少量CO2 | 2OH-+CO2=CO32-+H2O |
| D | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+=SO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
5.下列实验方案能达到相应实验目的是( )
| 选项 | 实验目的 | 方案 |
| A | 除去乙酸乙酯中的乙酸 | 用NaOH溶液洗涤,分液,然后干燥 |
| B | 制备少量漂白粉 | Cl2通人澄清石灰水中,然后蒸发结晶 |
| C | 检验食盐中是否添加KIO3 | 食盐溶解,然后加入淀粉溶液 |
| D | 测定醋酸溶液浓度 | 酚酞作指示剂,用标准NaOH溶液滴定 |
| A. | A | B. | B | C. | C | D. | D |
2.X、Y、Z、W、Q是五种原子序数依次增大的短周期元素,除Z外的另外四种元素在周期表中的位置如图所示,其中Y、W、Q的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物间均能发生反应,下列说法中正确的是( )
| X | Y | ||
| W | Q |
| A. | 简单离子半径大小关系为:W>Z>Y | |
| B. | 核外最外层电子数:Q>Y>X>W>Z | |
| C. | X与氢元素形成的化合物中,只含极性键 | |
| D. | 常见单质的熔沸点:X>W>Z |
3.化学与人类的生活、生产息息相关,下列说法正确的是( )
| A. | BaSO4在医学上用作“钡餐”,Ba2+对人体无害 | |
| B. | 高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性 | |
| C. | 光导纤维的主要成分是单质硅,太阳能电池使用的材料是SiO2 | |
| D. | “地沟油”禁止食用,但可以用来制肥皂或燃油 |