题目内容
16. 常温下,在20mL0.1mol•L-1 H2R溶液中滴加0.1mol•L-1 NaOH溶液,混合溶液的pH与滴加氢氧化钠溶液体积(V)的关系如图所示.下列说法不正确的是( )
常温下,在20mL0.1mol•L-1 H2R溶液中滴加0.1mol•L-1 NaOH溶液,混合溶液的pH与滴加氢氧化钠溶液体积(V)的关系如图所示.下列说法不正确的是( )| A. | HR-的电离程度大于水解程度 | |
| B. | ②点对应溶液中离子浓度的关系c(Na+)<c(H2R)+c(HR-)+c(R2-) | |
| C. | 在①、②、③点对应的溶液中,水电离的c(H+)•c(OH-)最大的是③ | |
| D. | 滴定前,溶液中存在粒子浓度大小关系:c(H2R)>c(H+)>c(HR-)>c(R2-)>c(OH-) |
分析 A、图象分析可知氢氧化钠溶液加入20ml反应生成NaHR溶液,溶液PH大于7显碱性,HR-水解程度大于电离程度;
B、②溶液显中性,溶质为H2R和NaHR的电离起到抑制,结合溶液中物料守恒分析;
C、酸碱溶液对水的电离起到抑制作用,水解的盐对水的电离起到促进作用;
D、H2R为二元弱酸分步电离,据此分析溶液中存在粒子浓度大小关系.
解答 解:A、图象分析可知氢氧化钠溶液加入20ml反应生成NaHR溶液,H2R+NaOH=NaHR+H2O,溶液PH大于7显碱性,HR-水解程度大于电离程度,故A错误;
B、②溶液显中性,溶质为H2R和NaHR,依据溶液中物料守恒可知,c(Na+)<c(H2R)+c(HR-)+c(R2-),故B正确;
C、在①、②、③点对应的溶液中,①溶液在酸过量、②中是H2R和NaHR的溶液,③为NaHR溶液对水的电离起到促进作用,所以水电离的c(H+)•c(OH-)最大的是③,故C正确;
D、20mL0.1mol•L-1 H2R溶液,H2R为二元弱酸分步电离,H2R?H++HR-,HR-?H++R2-,溶液中离子浓度大小为:c(H2R)>c(H+)>c(HR-)>c(R2-)>c(OH-),故D正确;
故选A.
点评 本题考查酸碱混合溶液定性判断,为高考常见题型,题目难度中等,试题侧重于学生的分析能力的考查,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,抓住图象进行分析即可.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
7.克菌丹(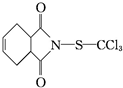 )是一种广谱性的主要用于叶面保护的杀菌剂,无药害,在果树、蔬菜及各种经济作物上使用.下列说法正确的是( )
)是一种广谱性的主要用于叶面保护的杀菌剂,无药害,在果树、蔬菜及各种经济作物上使用.下列说法正确的是( )
 )是一种广谱性的主要用于叶面保护的杀菌剂,无药害,在果树、蔬菜及各种经济作物上使用.下列说法正确的是( )
)是一种广谱性的主要用于叶面保护的杀菌剂,无药害,在果树、蔬菜及各种经济作物上使用.下列说法正确的是( )| A. | 克菌丹的分子式为C9H8O2NSCl3,属于芳香族化合物 | |
| B. | 克菌丹易溶于水,在加热条件下不能与NaOH溶液反应 | |
| C. | 克菌丹能与溴的CCl4溶液发生取代反应使之褪色 | |
| D. | 克菌丹在一定条件下能发生取代、加聚等反应 |
4.在MgCl2和AlCl3的混合溶液中,Cl-的物质的量为0.7mol,Al3+与Mg2+的物质的量之比为1:2.向该溶液中逐渐加入100mL 8mol•L-1 NaOH溶液,使之充分反应.下列叙述不正确是( )
| A. | 溶液中MgCl2的物质的量为0.1 mol | |
| B. | 当加入87.5 mL NaOH溶液时,沉淀质量最大 | |
| C. | 当加入90.0 mL NaOH溶液时,溶液中NaAlO2与NaCl的物质的量之比为2:35 | |
| D. | 当100 mL NaOH溶液刚好完全消耗时,Al3+恰好全部转化为Al${O}_{2}^{-}$ |
11.次磷酸盐可用于化学镀,向盛有次磷酸钠和氢氧化钠混合溶液的铁质容器中加入硫酸铜溶液,容器内壁形成牢固的铜镀层,其原理为H2PO2-+Cu2++X-→PO43-+Cu+H2O(未配平),下列有关说法正确的是( )
| A. | 该反应中次磷酸根离子得电子,表现还原性 | |
| B. | 该反应中氧化剂与还原剂的物质的量之比为1:1 | |
| C. | 该反应每消耗3 molX,转移电子的物质的量为2mol | |
| D. | 若将硫酸铜溶液换成硝酸银溶液,容器内壁不会形成镀层 |
8.下列实验设计正确的是( )
| A. | SO2中混有CO2,通入饱和NaHSO3溶液,除CO2 | |
| B. | NaCl溶液中混有NaAlO2,通入适量CO2以将Al元素转化为Al(OH)3沉淀,过滤即可 | |
| C. | 欲制备FeCl2固体,可将过量的铁粉在少量氯气中燃烧的方式获得 | |
| D. | 除去SiO2中的Al2O3,加稍过量的稀盐酸,过滤、洗涤、干燥即可 |
5.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 能使甲基橙变红的溶液中:Na+、Fe2+、SO42-、MnO4- | |
| B. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:K+、Na+、Cl-、HCO3- | |
| C. | 0.1 mol•L-1的NH4I溶液中:Mg2+、Na+、ClO-、NO3- | |
| D. | 0.1 mol•L-1的CuSO4溶液中:Mg2+、Al3+、Br-、Cl- |
6.常温下,实验测得下列四种物质的pH如图所示,下列说法错误的是( )


| A. | 苹果汁的c(H+)=0.3mol•L-1 | B. | 生理盐水是一种中性溶液 | ||
| C. | 石灰水的碱性比肥皂水强 | D. | 石灰水与苹果汁能发生中和反应 |