题目内容
某化学反应2A(g)?B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0.反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L?min).
(2)在实验2,A的初始浓度c2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 .
(3)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热).
| 序号 | 温度 | 0min | 10min | 20min | 30min | 40min | 50min | 60min |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验1,反应在10至20分钟时间内平均速率为
(2)在实验2,A的初始浓度c2=
(3)比较实验4和实验1,可推测该反应是
考点:化学反应速率的影响因素,吸热反应和放热反应,反应速率的定量表示方法,化学平衡建立的过程
专题:化学平衡专题
分析:(1)根据v=
计算;
(2)根据实验1、2数据分析;
(3)根据温度对化学平衡的影响判断.
| △c |
| △t |
(2)根据实验1、2数据分析;
(3)根据温度对化学平衡的影响判断.
解答:
解:(1)v=
=
=0.013mol/(L.min),
故答案为 0.013;
(2)根据实验1、2数据分析,温度相同,达平衡后A的物质的量浓度相同,且B、D起始浓度为0,所以两组实验中A的起始浓度相同为1.0mol?L-1 ;温度相同,达平衡后A的物质的量浓度相同,但达平衡时2组的时间较短,所以只能是加入催化剂,
故答案为:1.0;催化剂;
(3)实验4与实验1比,温度升高,达平衡时A的平衡浓度减小;温度升高,化学平衡向吸热方向移动,所以正反应是吸热反应.
故答案为:吸热.
| △c |
| △t |
| 0.80-0.67 |
| 20-10 |
故答案为 0.013;
(2)根据实验1、2数据分析,温度相同,达平衡后A的物质的量浓度相同,且B、D起始浓度为0,所以两组实验中A的起始浓度相同为1.0mol?L-1 ;温度相同,达平衡后A的物质的量浓度相同,但达平衡时2组的时间较短,所以只能是加入催化剂,
故答案为:1.0;催化剂;
(3)实验4与实验1比,温度升高,达平衡时A的平衡浓度减小;温度升高,化学平衡向吸热方向移动,所以正反应是吸热反应.
故答案为:吸热.
点评:本题考查影响化学反应速率和化学平衡的因素,难度中等.对数据的对比分析是解题的关键.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
下列关于水的说法,正确的是( )
| A、淡水资源丰富,可任意使用 |
| B、生活污水可任意排放 |
| C、水蒸发时,水分子体积变大 |
| D、硬水和软水可用肥皂水区分 |
几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A、X离子的氧化性比Y离子氧化性弱 |
| B、一定条件下,Z单质与W的常见单质直接生成ZW2 |
| C、Y的最高价氧化物对应的水化物能溶于稀氨水 |
| D、一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
下列过程中,共价键没有被破坏的是( )
| A、NH4Cl加热分解 |
| B、HCl气体溶于水 |
| C、金属钠放入水中 |
| D、碘升华 |

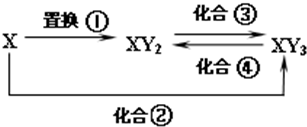 元素X的单质、Y单质及X与Y形成的化合物能按如下图所示的关系发生转化,图中化合反应均为与X或Y单质的反应,且Y单质为气体,
元素X的单质、Y单质及X与Y形成的化合物能按如下图所示的关系发生转化,图中化合反应均为与X或Y单质的反应,且Y单质为气体,