题目内容
 25℃,在20mL 0.1mol?L-1氨水溶液中逐滴加入0.1mol?L-1 HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是( )
25℃,在20mL 0.1mol?L-1氨水溶液中逐滴加入0.1mol?L-1 HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是( )| A、可以选择酚酞作指示剂 |
| B、在C点,V1<10,且有c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| C、在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| D、在D点:c(NH4+)+c(NH3?H2O)═c(Cl-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:氨水呈碱性,盐酸呈酸性,向氨水中加入盐酸,发生酸碱中和反应导致溶液的pH值降低,当盐酸和氨水的物质的量相等时,恰好生成氯化铵;当继续加盐酸时,盐酸的物质的量远远大于氨水时,溶液中以盐酸为主,溶液的pH值近似于盐酸的pH值;溶液中根据物料守恒和电荷守恒判断溶液中离子浓度的相对大小.
解答:
解:A、应选两者恰好完全反应时溶液的溶液的PH,指示剂变色范围全部或一部分在滴定突跃范围内,所以应选择甲基橙,故A错误;
B、氯化铵是强酸弱碱盐,其水溶液呈酸性,当溶液的pH=7时,氨水的量应稍微过量,所以盐酸的体积小于20mL;溶液呈中性导致c(OH-)=c(H+),根据溶液呈电中性得c(NH4+)=c(Cl-),溶液是氯化铵溶液所以各种离子的关系为:c(NH4+)=c(Cl-)>c(OH-)=c(H+),故B错误;
C、在A、C间任一点,当盐酸的量很少时,溶液中以氨水的电离为主,所以溶液中离子存在的关系可能是c(NH4+)>c(OH-)>c(Cl-)>c(H+),故C错误;
D、在D点时,根据物料守恒知,n(NH3?H2O)+n(NH4+)=0.002mol,n(Cl-)=0.002mol,溶液的体积相同,所以c(NH4+)+c(NH3?H2O)=c(Cl-)故D正确.
故选:D.
B、氯化铵是强酸弱碱盐,其水溶液呈酸性,当溶液的pH=7时,氨水的量应稍微过量,所以盐酸的体积小于20mL;溶液呈中性导致c(OH-)=c(H+),根据溶液呈电中性得c(NH4+)=c(Cl-),溶液是氯化铵溶液所以各种离子的关系为:c(NH4+)=c(Cl-)>c(OH-)=c(H+),故B错误;
C、在A、C间任一点,当盐酸的量很少时,溶液中以氨水的电离为主,所以溶液中离子存在的关系可能是c(NH4+)>c(OH-)>c(Cl-)>c(H+),故C错误;
D、在D点时,根据物料守恒知,n(NH3?H2O)+n(NH4+)=0.002mol,n(Cl-)=0.002mol,溶液的体积相同,所以c(NH4+)+c(NH3?H2O)=c(Cl-)故D正确.
故选:D.
点评:本题考查了酸碱中和反应中pH值图象的分析,难度不大,注意特殊点的分析,1.未加盐酸溶液时,2.酸碱恰好反应时,3.溶液的pH=7时.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述不正确的是( )


| A、在核电站厂区,较多使用的安全标识是图2 |
| B、在垃圾分类中,废电池属于图4 |
C、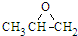 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物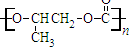 ,反应符合绿色化学的原则 ,反应符合绿色化学的原则 |
| D、图5 装置内发生的反应有化合、分解和置换反应 |
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、2.8克乙烯和丙烯的混合气体中所含碳原子数为0.2 NA |
| B、0.1mol CnH2n+2含有C-C数为0.1nNA个 |
| C、标准状况下,22.4L CCl4含有NA个CCl4分子 |
| D、1mol苯乙烯含有的C=C数为4NA |
下列物质的俗称、主要成分及主要用途对应错误的是( )
| 俗称 | 干冰 | 石炭酸 | 纯碱 | 硫铁矿 |
| 主要成分 | CO2 | 苯酚 | NaHCO3 | FeS2 |
| 用途 | 做制冷剂 | 制酚醛树脂 | 除油污 | 制硫酸 |
| A | B | C | D |
| A、A | B、B | C、C | D、D |
能正确表示下列反应的离子方程式的是( )
| A、NaOH溶液中加入铝片:Al+2OH-═AlO2-+H2↑ |
| B、NaHCO3溶液水解:HCO3-+H2O?H3O++CO32- |
| C、NH4HCO3溶液与足量烧碱溶液混合:HCO3-+OH-═CO32-+H2O |
| D、硫酸溶液与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
关于硅及其化合物的叙述中,错误的是( )
| A、光导纤维的主要化学成分是SiO2 |
| B、SiO2和CO2都是酸性氧化物,都能与强碱溶液反应 |
| C、SiO2和CO2都能溶于水且与水反应生成相应的酸 |
| D、硅属于非金属,是良好的半导体材料 |



 火力发电厂在发电过程中会释放大量的
火力发电厂在发电过程中会释放大量的