题目内容
下列离子方程式书写正确的是( )
| A、在漂白粉的溶液中通入少量二氧化硫气体:Ca2++2ClO-+SO2+H2O=CaSO3+↓2HClO | ||||
B、用惰性电极电解饱和食盐水Cl-+H2O
| ||||
| C、氯化亚铁溶液中滴人少量双氧水2Fe2++2H++H2O2=2Fe3++2H2O | ||||
| D、等物质的量浓度、等体积的Ca(HCO3)2溶液与氢氧化钠溶液相混合:Ca2++2HCO3-=CaCO3↓+CO32-+2H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.次氯酸根具有强的氧化性能够氧化亚硫酸根离子;
B.原子个数不守恒;
C.氯化亚铁溶液中滴人少量双氧水发生氧化反应生成氯化铁;
D.等物质的量浓度、等体积的Ca(HCO3)2溶液与氢氧化钠溶液反应生成碳酸钙、碳酸氢钠和水.
B.原子个数不守恒;
C.氯化亚铁溶液中滴人少量双氧水发生氧化反应生成氯化铁;
D.等物质的量浓度、等体积的Ca(HCO3)2溶液与氢氧化钠溶液反应生成碳酸钙、碳酸氢钠和水.
解答:
解:A.在漂白粉的溶液中通入少量二氧化硫气体,离子方程式为:Ca2++2ClO-+SO2+H2O=CaSO4↓+HClO+H++Cl-,故A错误;
B.用惰性电极电解饱和食盐水,离子方程式:2Cl-+2H2O
H2↑+Cl2+2OH-,故B错误;
C.氯化亚铁溶液中滴人少量双氧水,离子方程式:2Fe2++2H++H2O2=2Fe3++2H2O,故C正确;
D.等物质的量浓度、等体积的Ca(HCO3)2溶液与氢氧化钠溶液相混合,离子方程式:OH-+Ca2++HCO3-=CaCO3↓+H2O,故D错误;
故选:C.
B.用惰性电极电解饱和食盐水,离子方程式:2Cl-+2H2O
| ||
C.氯化亚铁溶液中滴人少量双氧水,离子方程式:2Fe2++2H++H2O2=2Fe3++2H2O,故C正确;
D.等物质的量浓度、等体积的Ca(HCO3)2溶液与氢氧化钠溶液相混合,离子方程式:OH-+Ca2++HCO3-=CaCO3↓+H2O,故D错误;
故选:C.
点评:本题考查了离子方程式的书写,侧重考查氧化还原反应、反应物用量不同发生反应不同,明确反应实质是解题关键.

练习册系列答案
相关题目
氧气的摩尔质量为( )
| A、32g |
| B、32mol |
| C、32 |
| D、32 g/mol |
制备乙酸乙酯的一条合成路线为:下列说法错误的是( )
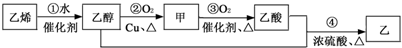

| A、乙的结构简式为CH3COOCH2CH3 | |||
| B、乙醇与CH3OCH3(二甲醚)互为同分异构体 | |||
| C、反应①属于加成反应 | |||
D、反应②的化学方程式为2CH3CH2OH+O2
|
按分散质微粒大小不同可将分散系分为胶体、溶液和浊液,胶体微粒大小为( )
| A、0.01nm~1nm |
| B、0.1nm~10nm |
| C、1nm~100nm |
| D、10nm~1000nm |


 可作为果味香精.请设计合理方案以
可作为果味香精.请设计合理方案以 、CH3CH20H为原料合成
、CH3CH20H为原料合成 (用合成路线流程图表示,并注明反应条件).
(用合成路线流程图表示,并注明反应条件).


 ,所需溴代烃的结构简式为
,所需溴代烃的结构简式为


 则E的结构简式为
则E的结构简式为