题目内容
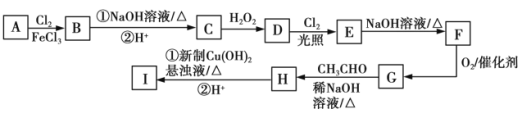
【题目】实验室中用氯气与粗铜![]() 杂质只有Fe)反应,制备CuCl2·2H2O晶体的流程如下
杂质只有Fe)反应,制备CuCl2·2H2O晶体的流程如下

已知:氯化铜从水溶液中结晶时,所得晶体CuCl2·2H2O与温度关系如下
温度 | 小于15℃ | 15—25.7℃ | 26—42℃ | 42—100℃ | 100℃以上 |
晶体 | CuCl2·4H2O | CuCl2·3H2O | CuCl2·2H2O | CuCl2·H2O | CuCl2 |
下列说法不正确的是
A.制备氯气的反应:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
B.由溶液乙制备纯净CuCl2·2H2O晶体的系列操作步骤为:加少量盐酸、蒸发浓缩、冷却到室温结晶、过滤、洗涤、干燥。
C.固体乙是氢氧化铁
D.此流程中溶解固体甲的酸只能是盐酸
【答案】B
【解析】
由流程图可知,粗铜中杂质只有Fe,与氯气反应得到固体甲中有氯化铜、氯化铁,用盐酸溶解,抑制氯化铜、氯化铁水解,溶液甲中加入X调节溶液pH,得到溶液乙,经过系列操作得到CuCl2·2H2O,故溶液乙为CuCl2溶液,则调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,试剂X可以为CuO、氢氧化铜等,结合题目信息可知,氯化铜溶液,加少量盐酸,抑制氯化铜水解,再蒸发浓缩、冷却到26—42℃结晶得到CuCl2·2H2O,再经过过滤、洗涤、干燥得到纯净的晶体。
A.由流程可知,用MnO2和浓盐酸来制备氯气,反应的化学方程式为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,故A正确;
MnCl2+Cl2↑+2H2O,故A正确;
B.由分析可知,由CuCl2溶液制备纯净CuCl2·2H2O晶体的系列操作步骤为:加少量盐酸、蒸发浓缩、冷却到26—42℃结晶得到CuCl2·2H2O、过滤、洗涤、干燥,故B错误;
C. 由分析可知,固体乙是氢氧化铁,故C正确;
D.盐酸易挥发,且阴离子为氯离子,所以此流程中溶解固体甲的酸只能是盐酸,故D正确;
故选B。

 名校课堂系列答案
名校课堂系列答案【题目】某学习小组利用二氧化氯![]() 制备消毒剂、漂白剂亚氯酸钠
制备消毒剂、漂白剂亚氯酸钠![]() ,有关反应原理:
,有关反应原理:![]() 放热反应
放热反应![]()
实验一、制备![]() 晶体
晶体
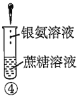
选择如图所示装置设计实验制备亚氯酸钠晶体
已知:饱和![]() 溶液析出晶体与度关系如下表所示:
溶液析出晶体与度关系如下表所示:
温度 |
|
|
|
品体成分 |
|
|
|
⑴装置连接顺序:![]() ______
______
⑵C装置的作用是______D装置作用是______
⑶A装置中选择![]() 浓硫酸的理由是______
浓硫酸的理由是______
⑷写出E装置中发生反应的离子方程式______
⑸对B装置中溶液采用结晶法提取无水亚氯酸钠晶体,操作分别为蒸发结晶、趁热过滤、用![]() 左右热水洗涤、低于
左右热水洗涤、低于![]() 条件下干燥,得到成品,蒸发结晶时控制温度为______
条件下干燥,得到成品,蒸发结晶时控制温度为______
实验二、测定产品纯度
⑹准确称量/span>ag产品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应:![]() ,将所得混合溶液稀释成250mL待测液。取
,将所得混合溶液稀释成250mL待测液。取![]() 待测液于锥形瓶,加入淀粉溶液作指示剂,用
待测液于锥形瓶,加入淀粉溶液作指示剂,用![]() 标准
标准![]() 溶液滴定至终点,测得消耗
溶液滴定至终点,测得消耗![]() 标准溶液的体积为
标准溶液的体积为![]() (已知:
(已知:![]() )
)
![]() 该产品纯度为______(只要求列出计算式)
该产品纯度为______(只要求列出计算式)
![]() 若滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失,则测得结果______(填“偏高偏低”或“无影响”)
若滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失,则测得结果______(填“偏高偏低”或“无影响”)