题目内容
1.乙醇与乙醛的相对分子质量相差不大,但乙醇的沸点(78.5℃)却比乙醛的沸点(20.8℃)高出许多,其原因是乙醇分子间存在氢键,而乙醛分子间不存在氢键.分析 分子间氢键的存在导致物质的熔沸点升高,据此分析解答.
解答 解:氢键的作用力大于范德华力,则分子间形成氢键的沸点较高,C2H5OH分子间存在氢键,而CH3CHO分子间不能形成氢键,所以乙醇的沸点比乙醛的高,
故答案为:乙醇分子间存在氢键,而乙醛分子间不存在氢键.
点评 本题考查了分子晶体沸点高低比较,分子间氢键的作用力大于范德华力,则分子间形成氢键的沸点会反常的升高,这在解题过程中是比较容易遗忘的,要细心.

练习册系列答案
相关题目
12.下列叙述正确的是( )
| A. | 蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有性脱水性 | |
| B. | 硫粉在过量的氧气中燃烧可以生成SO3 | |
| C. | 将SO2通入BaCl2溶液能生成白色沉淀 | |
| D. | 可用澄清石灰水溶液鉴别 CO2和SO2 |
9.下列溶液中的c(Cl-)与50mL 1mol•L-1 AlCl3溶液中c(Cl-)相等的是( )
| A. | 150mL 1mol•L-1 NaCl溶液 | B. | 75mL 2mol•L-1 NH4Cl溶液 | ||
| C. | 50mL 3mol•L-1KClO3溶液 | D. | 50mL 1mol•L-1 FeCl3溶液 |
16.ClO2是一种杀菌消毒效率高、二次污染小的水处理剂.实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法不正确的是( )
| A. | CO2是氧化产物 | |
| B. | KClO3在反应中发生还原反应 | |
| C. | 生成5.6LCO2,转移的电子数目为0.25NA | |
| D. | 24.5g KClO3参加反应,转移电子物质的量为0.2mol |
13.把足量的铁粉投入到硫酸与硫酸铜的混合溶液中,充分反应后,残余固体的质量与原来加入的铁粉的质量相等,则原溶液中H+和SO42-的物质的量之比为( )
| A. | 1:4 | B. | 2:7 | C. | 1:2 | D. | 8:3 |
10.下列不属于配合物的是( )
| A. | [Cu(NH3)4]SO4•H2O | B. | [Ag(NH3)2]OH | C. | NH4NO3 | D. | Na[Al(OH)4] |
16.已知同一碳原子连有两个羟基不稳定: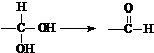
有机物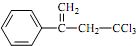 是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草,温度和湿度对药效影响大,温度高、湿度大药效发挥快.下列有关该有机物的说法正确的是( )
是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草,温度和湿度对药效影响大,温度高、湿度大药效发挥快.下列有关该有机物的说法正确的是( )
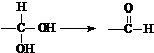
有机物
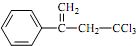 是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草,温度和湿度对药效影响大,温度高、湿度大药效发挥快.下列有关该有机物的说法正确的是( )
是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草,温度和湿度对药效影响大,温度高、湿度大药效发挥快.下列有关该有机物的说法正确的是( )| A. | 属于卤代烃,不能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | 该物质存在顺反异构 | |
| C. | 在碱性条件下充分水解,可生成羧酸盐 | |
| D. | 1mol 该物质在一定条件下可与 3molH2发生加成反应 |
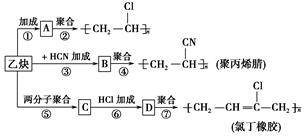

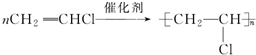 ;
;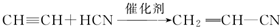 ;
;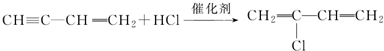 .
.