题目内容
最近,科学家冶炼出纯度高达99.999%的铝,你估计它具有性质是( )
| A、熔点比铁铝合金小 |
| B、在冷、浓HNO3中可以钝化 |
| C、在空气中放置容易生锈,进而被腐蚀 |
| D、当它与铁的粉碎粒度相同时,与4mol/L盐酸反应速率比纯铁大 |
考点:合金的概念及其重要应用,铝的化学性质
专题:几种重要的金属及其化合物
分析:A.铁铝是合金,铝为金属单质,合金熔点低;
B.铝能在冷的浓硫酸中可发生钝化;
C.铝在空气中放置容易生成氧化铝,进而防止被腐蚀;
D.铁的金属性弱于铝,反应速率慢.
B.铝能在冷的浓硫酸中可发生钝化;
C.铝在空气中放置容易生成氧化铝,进而防止被腐蚀;
D.铁的金属性弱于铝,反应速率慢.
解答:
解:A.铁铝是合金,合金的硬度大,熔点低,纯度高达99.999%的铝熔点高,故A错误;
B.铁能在冷的浓硫酸中可发生钝化生成致密的氧化膜阻止反应进一步进行而不溶解,故B正确;
C.铝属于活泼金属,在空气中易被氧气氧化生成氧化铝,阻止反应进一步进行,进而防止被腐蚀,故C错误;
D.金属与酸反应的快慢与金属的本性有关,铝的金属活泼性强于铁,所以与4mol/L盐酸反应速率比纯铁大,故D正确;
故选BD.
B.铁能在冷的浓硫酸中可发生钝化生成致密的氧化膜阻止反应进一步进行而不溶解,故B正确;
C.铝属于活泼金属,在空气中易被氧气氧化生成氧化铝,阻止反应进一步进行,进而防止被腐蚀,故C错误;
D.金属与酸反应的快慢与金属的本性有关,铝的金属活泼性强于铁,所以与4mol/L盐酸反应速率比纯铁大,故D正确;
故选BD.
点评:本题考查铝与合金的性质,题目难度不大,注意铝和氧气反应生成氧化铝保护内层金属.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
10ml1mol/L的NH3﹒H2O与5ml 2mol/l的盐酸恰好完全中和,最后溶液中所含离子的浓度大小顺序是( )
| A、[H+]>[NH4+]>[Cl-]>[OH-] |
| B、[NH4+]=[Cl-]>[H+]>[OH-] |
| C、[Cl-]>[NH4+]>[OH-]>[H+] |
| D、[Cl-]>[NH4+]>[H+]>[OH-] |
氯气能使紫色石蕊溶液( )
| A、褪色 | B、变成红色 |
| C、先褪色后变红 | D、先变红后褪色 |
下列各组混合物中,可以直接用分液漏斗分离的是( )
| A、酒精和碘 | B、苯酚和乙醇 |
| C、乙醇和水 | D、溴乙烷和水 |
某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:测定剩余固体的质量,下列有关判断中不正确的是( )
方案Ⅰ:铜铝混合物
测定生成气体的体积 方案Ⅱ:铜铝混合物
测定剩余固体的质量.
方案Ⅰ:铜铝混合物
| 足量溶液A |
| 充分反应 |
| 足量溶液B |
| 充分反应 |
| A、溶液A和B均可以是盐酸或NaOH溶液 |
| B、溶液A和B不可以均选用稀硝酸 |
| C、若溶液B选用浓硝酸,则测得铜的质量分数偏大 |
| D、实验室方案Ⅱ更便于实施 |
已知:P4(s、白磷)+5O2(g)═P4O10(s);△H=-2983.2kJ/mol4P(s、红磷)+5O2(g)═P4O10(s);△H=-2954kJ/mol
那么,1mol红磷转变成相应物质的量白磷时,应是( )
那么,1mol红磷转变成相应物质的量白磷时,应是( )
| A、吸收29.2kJ热量 |
| B、放出29.2kJ热量 |
| C、放出7.3kJ热量 |
| D、吸收7.3kJ热量 |
将装有20mL NO、NO2混合气体的量筒倒立于水槽中,充分反应后量筒内气体体积缩小为10mL,则原混合气体中NO、NO2的体积比是( )
| A、3:2 | B、2:3 |
| C、3:1 | D、1:3 |
已知乙烯分子是平面结构,因此1,2-二氯乙烯可形成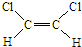 和
和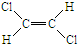 两种不同的空间异构体,称为顺反异构.下列能形成类似上述空间异构体的是( )
两种不同的空间异构体,称为顺反异构.下列能形成类似上述空间异构体的是( )
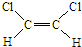 和
和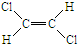 两种不同的空间异构体,称为顺反异构.下列能形成类似上述空间异构体的是( )
两种不同的空间异构体,称为顺反异构.下列能形成类似上述空间异构体的是( )| A、1-丁烯 | B、2-甲基-1-丙烯 |
| C、2-丁烯 | D、丁烷 |