题目内容
我省盛产矿盐(主要成分是NaCl,还含有SO42-等其他可溶性杂质的离子).下列有关说法正确的是( )
| A、有矿盐生成食盐,除去SO42- 最合适的实际是Ba(NO3)2 |
| B、工业上通过电解氯化钠溶液制备金属钠和氯气 |
| C、用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液 |
| D、室温下,AgCl在水中的溶解度小于在食盐中的溶解度 |
考点:物质的分离、提纯的基本方法选择与应用,盐类水解的应用,难溶电解质的溶解平衡及沉淀转化的本质,金属冶炼的一般原理,物质的分离、提纯和除杂
专题:离子反应专题,电离平衡与溶液的pH专题
分析:A.除杂不能引入新杂质;
B.电解氯化钠溶液,生成NaOH、氢气、氯气;
C.纯碱溶液显碱性,酚酞的变色范围为8-10;
D.存在AgCl(s)?Ag+(aq)+Cl-(aq),结合平衡移动分析.
B.电解氯化钠溶液,生成NaOH、氢气、氯气;
C.纯碱溶液显碱性,酚酞的变色范围为8-10;
D.存在AgCl(s)?Ag+(aq)+Cl-(aq),结合平衡移动分析.
解答:
解:A.除杂不能引入新杂质,则除去SO42- 最合适的实际是BaCl2,故A错误;
B.电解氯化钠溶液,生成NaOH、氢气、氯气,则电解熔融NaCl制备金属钠和氯气,故B错误;
C.纯碱溶液显碱性,酚酞的变色范围为8-10,则加酚酞变红的为碳酸钠,无色的为NaCl,可鉴别,故C正确;
D.存在AgCl(s)?Ag+(aq)+Cl-(aq),在NaCl溶液中抑制溶解,则溶解度小,则室温下,AgCl在水中的溶解度大于在食盐中的溶解度,故D错误;
故选C.
B.电解氯化钠溶液,生成NaOH、氢气、氯气,则电解熔融NaCl制备金属钠和氯气,故B错误;
C.纯碱溶液显碱性,酚酞的变色范围为8-10,则加酚酞变红的为碳酸钠,无色的为NaCl,可鉴别,故C正确;
D.存在AgCl(s)?Ag+(aq)+Cl-(aq),在NaCl溶液中抑制溶解,则溶解度小,则室温下,AgCl在水中的溶解度大于在食盐中的溶解度,故D错误;
故选C.
点评:本题考查较综合,涉及混合物的分离提纯、物质的鉴别、电解原理、溶解平衡移动等,综合性较强,注重高频考点的考查,题目难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案
相关题目
16O与18O互为同位素,下列说法正确的是( )
| A、16O与18O具有相同的中子数 |
| B、16O与18O具有不同的电子数 |
| C、16O与18O具有相同的质子数 |
| D、16O与18O原子的最外层电子数均为2 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、滴加石蕊试液显红色的溶液:Fe3+、SO42-、Cl-、SCN- | ||
| B、滴加甲基橙呈红色的溶液:NH4+、Ba2+、Al3+、Cl- | ||
C、
| ||
| D、c(AI3+)=0.5mol?L-1的溶液:Na+、K+、HCO3-、SO42- |
绿原酸的结构简式如图所示,下列有关绿原酸的叙述不正确的是( )


| A、绿原酸的分子式为C16H18O9 |
| B、一定不能使Na2CO3溶液放出气体 |
| C、0.5mol绿原酸最多与2mol NaOH反应 |
| D、能发生取代反应,加成反应和消去反应 |
下列表达方式不正确的是( )
A、二氧化碳的电子式是 | ||
B、氟化钠的电子式  | ||
C、S2-离子的结构示意图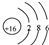 | ||
D、镁-24原子
|
下列说法中正确的是( )
| A、SO2、BF3、NCl3分子中所有原子的最外层都满足8电子稳定结构 |
| B、P4和CH4都是正四面体型分子且键角都为109°28′ |
| C、NaCl晶体中与每个Na+ 距离相等且最近的Na+共有12个 |
| D、原子间通过共价键而形成的晶体一定具有高的熔、沸点及硬度 |
下列各图中,表示正反应是放热反应的图是.( )
A、 |
B、 |
C、 |
D、 |
在2p能级上最多只能排布6个电子,其依据的规律是( )
| A、能量最低原理 |
| B、泡利不相容原理 |
| C、洪特规则 |
| D、能量最低原理和泡利不相容原理 |
C4H10在光照条件下与氯气发生取代反应可生成C4H9Cl,C4H8Cl2等一系列氯代烃,下列有关叙述中正确的是( )
| A、C4H10的同分异构体共有3种 |
| B、C4H9Cl的同分异构体共有3种 |
| C、C4H8Cl2的同分异构体共有6种 |
| D、生成的氯代烃中可能含有CH(CCl3)3 |