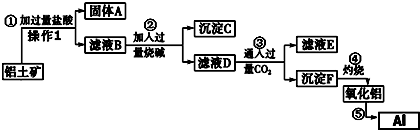
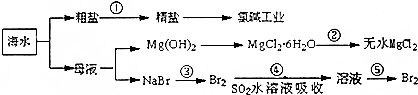
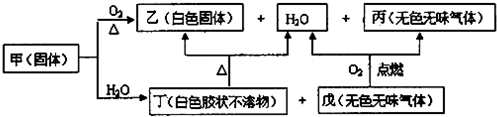
题目内容
2.某溶液中含有大量的下列离子:Fe3+、SO42-、Mg2+和M离子,经测定Fe3+、SO42-、Mg2+和M离子的物质的量之比为1:2:1:1,则M离子可能是下列中的( )| A. | Na+ | B. | OH- | C. | S2- | D. | Cl- |
分析 溶液中一定满足电荷守恒,根据电荷守恒判断M离子所带电荷,然后根据离子能否大量共存判断可能存在的离子.
解答 解:根据题目条件和电荷守恒可知:n(Fe3+)×3+n(Mg2+)×2=n(SO42-)×2+n(M),即:1×3+1×2=2×2+M,M=1,M带有1个单位的负电荷,
又OH-离子不能与铁离子大量共存,所以M只能为选项中的Cl-离子.
故选D.
点评 本题考查离子共存,为高频考点,把握电荷守恒及复分解反应为解答的关键,本题侧重考查电荷守恒的应用,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:①2Fe2++H2O2+2H+═2Fe3++2H2O,②2Fe3++H2O2═2Fe2++O2↑+2H+.下列说法不正确的是( )
| A. | 由反应①知H2O2的氧化性比Fe3+强,由反应②知H2O2的还原性比Fe2+强 | |
| B. | 在反应①、②中H2O2均作氧化剂被还原 | |
| C. | 在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
10.下列不属于我国“城市空气质量日报”报道内容的是( )
| A. | SO2 | B. | CO2 | C. | PM2.5 | D. | 空气质量等级 |
17.人们对原子结构的认识有一个不断深入的过程,下列先后顺序中符合史实的是( )
①道尔顿提出的原子论②卢瑟福的原子结构行星模型③玻尔提出的原子力学模型④汤姆孙提出的葡萄干面包原子模型.
①道尔顿提出的原子论②卢瑟福的原子结构行星模型③玻尔提出的原子力学模型④汤姆孙提出的葡萄干面包原子模型.
| A. | ①②③④ | B. | ①③②④ | C. | ②①④③ | D. | ①④②③ |
7.下列说法正确的是( )
| A. | 可用澄清石灰水鉴别Na2CO3和NaHCO3溶液 | |
| B. | 浓硫酸具有吸水性,可做干燥剂,但不能干燥NH3 | |
| C. | 钠保存在煤油中,若长期放置在空气中,最终变为NaHCO3 | |
| D. | 镁着火后可以用CO2来灭火 |
11.Fe(OH)3胶体和FeCl3溶液共同具备的性质是( )
| A. | 都比较稳定,久置不变浑浊 | B. | 相同的颜色 | ||
| C. | 有丁达尔现象 | D. | 加盐酸先产生沉淀,后沉淀溶解 |