题目内容
HA为一元弱酸,则在0.1mol?L-1NaA溶液中,离子浓度关系正确的是( )
| A、c(Na+)>c(A-)>c(H+)>c(OH-) |
| B、c(Na+)>c(OH-)>c(A-)>c(H+) |
| C、c(Na+)+c(H+)=c(A-)+c(OH-) |
| D、c(Na+)+c(OH-)=c(A-)+c(H+) |
考点:离子浓度大小的比较,盐类水解的应用
专题:盐类的水解专题
分析:根据HA为一元弱酸,则在0.1mol?L-1 NaA溶液中利用盐类水解及电荷守恒来分析溶液中离子的关系.
解答:
解:A、因HA为一元弱酸,则NaA溶液中A-+H20═HA+OH-,即溶液显碱性,则c(OH-)>c(H+),故A错误;
B、由溶液中A-+H20═HA+OH-,则c(OH-)>c(H+),但水解的程度很弱,则c(A-)>c(OH-)>c(H+),故B错误;
C、由电荷守恒可知,溶液中阳离子带的电荷总数等于阴离子带的电荷总数,则c(Na+)+c(H+)=c(A-)+c(OH-),故C正确;
D、由电荷守恒可知,溶液中阳离子带的电荷总数等于阴离子带的电荷总数,则c(Na+)+c(H+)=c(A-)+c(OH-),故D错误;
故选C.
B、由溶液中A-+H20═HA+OH-,则c(OH-)>c(H+),但水解的程度很弱,则c(A-)>c(OH-)>c(H+),故B错误;
C、由电荷守恒可知,溶液中阳离子带的电荷总数等于阴离子带的电荷总数,则c(Na+)+c(H+)=c(A-)+c(OH-),故C正确;
D、由电荷守恒可知,溶液中阳离子带的电荷总数等于阴离子带的电荷总数,则c(Na+)+c(H+)=c(A-)+c(OH-),故D错误;
故选C.
点评:本题考查溶液中离子的关系,正确利用水解来判断溶液的酸碱性是解答的关键,并注意溶液中水解的程度及利用电荷守恒来分析解答即可.

练习册系列答案
相关题目
下列说法正确的是( )
| A、摩尔是一个基本物理量 |
| B、CH4的摩尔质量为16g |
| C、在同温同压下,相同体积的任何气体单质所含分子数相同 |
| D、500mL,1mol/L MgCl2溶液中含有Cl-数目为0.5NA |
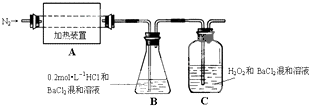 硫酸亚铁铵[(NH4)2Fe(SO4)2?6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁.硫酸亚铁铵在 500℃时隔绝空气加热完全分解.回答下列问题:
硫酸亚铁铵[(NH4)2Fe(SO4)2?6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁.硫酸亚铁铵在 500℃时隔绝空气加热完全分解.回答下列问题:


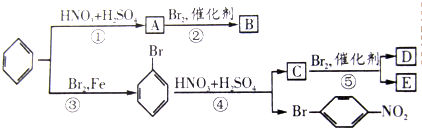


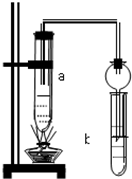 如图所示,在试管a中先加2mL乙醇,边摇动边缓缓加入5mL浓硫酸,摇匀冷却后,再加入2g无水醋酸钠,充分搅动后,固定在铁架台上.在试管b中加入适量的饱和Na2CO3溶液.连接好装置,给a加热,当观察到试管b中有明显现象时,停止实验.
如图所示,在试管a中先加2mL乙醇,边摇动边缓缓加入5mL浓硫酸,摇匀冷却后,再加入2g无水醋酸钠,充分搅动后,固定在铁架台上.在试管b中加入适量的饱和Na2CO3溶液.连接好装置,给a加热,当观察到试管b中有明显现象时,停止实验.