题目内容
将15.6g Na2O2和5.4g Al同时放入一定量水中,充分反应后得到200ml澄清溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若反应中溶液体积不变,则下列判断正确的是( )
| A、反应过程中得到6.72L的气体(标准状况) |
| B、最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) |
| C、最终得到7.8g沉淀 |
| D、最终得到的溶液中c(NaCl)=1.6mol/L |
考点:有关混合物反应的计算
专题:
分析:15.6gNa2O2的物质的量为
=0.2mol,5.4gAl的物质的量为
=0.2mol,首先发生反应:2Na2O2+2H2O═4NaOH+O2↑,生成NaOH为0.4mol,再发生反应:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知Al完全反应,剩余NaOH为0.4mol-0.2mol=0.2mol,生成NaAlO2为0.2mol,通入标准状况下的HCl气体6.72L,物质的量为
=0.3mol,首先发生反应:NaOH+HCl═NaCl+H2O,剩余HCl为0.3mol-0.2mol=0.1mol,再发生反应:NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,由方程式可知,NaAlO2有剩余,HCl完全反应,生成Al(OH)3为0.1mol,最终溶液中溶质为NaAlO2、NaCl,据此解答.
| 15.6g |
| 78g/mol |
| 5.4g |
| 27g/mol |
| 6.72L |
| 22.4L/mol |
解答:
解:15.6gNa2O2的物质的量为
=0.2mol,5.4gAl的物质的量为
=0.2mol,则:
首先:2Na2O2+2H2O═4NaOH+O2↑
0.2mol 0.4mol 2.24L
然后:2Al+2H2O+2NaOH═2NaAlO2+3H2↑
0.2mol 0.2mol 0.2mol 6.72L
故剩余NaOH为0.4mol-0.2mol=0.2mol,生成NaAlO2为0.2mol,生成O2为2.24L、H2为6.72L;
向溶液中通入标准状况下的HCl气体6.72L,物质的量为
=0.3mol,则:
HCl+NaOH═NaCl+H2O
0.2mol 0.2mol 0.2mol
剩余剩余HCl为0.3mol-0.2mol=0.1mol,生成0.2molNaCl,
NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,
0.1mol 0.1mol 0.1mol 0.1mol
故NaAlO2有剩余,HCl完全反应,剩余NaAlO2为0.2mol-0.1mol=0.1mol,生成Al(OH)3为0.1mol、NaCl为0.1mol,故溶液中含有0.3molNaCl、0.1molNaAlO2,
A.生成O2为2.24L、H2为6.72L,故生成气体总体积为2.24L+6.72L=8.96L,故A错误;
B.反应后溶液的成分是0.3mol NaCl和0.1mol NaAlO2,由电荷守恒可知c(Na+)=c(Cl-)+c(OH-)+c(AlO2-)-c(H+),故B错误;
C.最终生成Al(OH)3为0.1mol,质量为0.1mol×78g/mol=7.8g,故C正确;
D.根据氯离子守恒可知,反应后溶液中n(NaCl)=n(HCl)=0.3mol,故最终溶液中c(NaCl)=
=1.5mol/L,故D错误;
故选C.
| 15.6g |
| 78g/mol |
| 5.4g |
| 27g/mol |
首先:2Na2O2+2H2O═4NaOH+O2↑
0.2mol 0.4mol 2.24L
然后:2Al+2H2O+2NaOH═2NaAlO2+3H2↑
0.2mol 0.2mol 0.2mol 6.72L
故剩余NaOH为0.4mol-0.2mol=0.2mol,生成NaAlO2为0.2mol,生成O2为2.24L、H2为6.72L;
向溶液中通入标准状况下的HCl气体6.72L,物质的量为
| 6.72L |
| 22.4L/mol |
HCl+NaOH═NaCl+H2O
0.2mol 0.2mol 0.2mol
剩余剩余HCl为0.3mol-0.2mol=0.1mol,生成0.2molNaCl,
NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,
0.1mol 0.1mol 0.1mol 0.1mol
故NaAlO2有剩余,HCl完全反应,剩余NaAlO2为0.2mol-0.1mol=0.1mol,生成Al(OH)3为0.1mol、NaCl为0.1mol,故溶液中含有0.3molNaCl、0.1molNaAlO2,
A.生成O2为2.24L、H2为6.72L,故生成气体总体积为2.24L+6.72L=8.96L,故A错误;
B.反应后溶液的成分是0.3mol NaCl和0.1mol NaAlO2,由电荷守恒可知c(Na+)=c(Cl-)+c(OH-)+c(AlO2-)-c(H+),故B错误;
C.最终生成Al(OH)3为0.1mol,质量为0.1mol×78g/mol=7.8g,故C正确;
D.根据氯离子守恒可知,反应后溶液中n(NaCl)=n(HCl)=0.3mol,故最终溶液中c(NaCl)=
| 0.3mol |
| 0.2L |
故选C.
点评:本题考查混合物的计算、钠的化合物与铝单质及化合物的性质等,难度较大,根据过量计算判断发生的反应是解题的关键.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
下列说法正确的是( )
| A、干冰升华要吸收大量的热,这就是化学反应中的吸热反应 |
| B、凡是在加热或点燃条件下进行的反应都是吸热反应 |
| C、人们用氢氧焰焊接或切割金属,主要是利用了氢气和氧气化合时所放出的能量 |
| D、明矾有净水作用,所以用明矾处理硬水,可以使硬水软化 |
按“单质、氧化物、盐”的顺序排列的一组物质是( )
| A、SO2 S Na2SO4 |
| B、Si SiO2 Na2SiO3 |
| C、CO2 Na2CO3 C |
| D、Al Al2O3 Al(OH)3 |
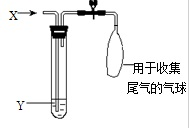 如图是检验气体性质的一种实验装置,请回答:
如图是检验气体性质的一种实验装置,请回答: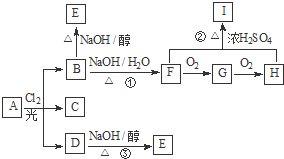 【化学--选修5有机化学基础】
【化学--选修5有机化学基础】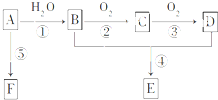 已知A是一种相对分子质量为42的气态烃,它可转化为其他常见有机物,转化关系如图所示.
已知A是一种相对分子质量为42的气态烃,它可转化为其他常见有机物,转化关系如图所示.