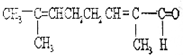题目内容
2.某饱和脂肪酸的甘油酯7.031g,加入50ml 0.5mol/L的NaOH后共热,当水解完全时,过量的NaOH恰好被13mL 0.1mol/L的盐酸中和,此水解后的饱和脂肪酸碳原子个数为( )| A. | 13 | B. | 14 | C. | 17 | D. | 18 |
分析 NaOH和HCl反应方程式为NaOH+HCl=NaCl+H2O,根据酸碱中和反应方程式知,参加中和反应的n(NaOH)=n(HCl)=0.1mol/L×0.013L=0.0013mol,则剩余NaOH和酯水解生成的羧酸反应,和羧酸反应的n(NaOH)=0.5mol/L×0.05L-0.0013mol=0.025mol-0.0013mol=0.0237mol,该酯是饱和脂肪酸甘油酯,则酯和NaOH反应的物质的量之比为1:3,则酯的物质的量=$\frac{1}{3}$×0.0237mol=0.0079mol,则该酯的摩尔质量=$\frac{7.031g}{0.0079mol}$=890g/mol,该羧酸摩尔质量=$\frac{890+18×3-92}{3}$g/mol=284g/mol,根据饱和脂肪酸通式计算C原子个数.
解答 解:NaOH和HCl反应方程式为NaOH+HCl=NaCl+H2O,根据酸碱中和反应方程式知,参加中和反应的n(NaOH)=n(HCl)=0.1mol/L×0.013L=0.0013mol,则剩余NaOH和酯水解生成的羧酸反应,和羧酸反应的n(NaOH)=0.5mol/L×0.05L-0.0013mol=0.025mol-0.0013mol=0.0237mol,该酯是饱和脂肪酸甘油酯,则酯和NaOH反应的物质的量之比为1:3,则酯的物质的量=$\frac{1}{3}$×0.0237mol=0.0079mol,则该酯的摩尔质量=$\frac{7.031g}{0.0079mol}$=890g/mol,该羧酸摩尔质量=$\frac{890+18×3-92}{3}$g/mol=284g/mol,饱和一元脂肪酸通式为CnH2nO2,则n=$\frac{284-32}{14}$=18,故选D.
点评 本题考查有机物分子式确定的有关计算,为高频考点,侧重考查学生分析计算能力,明确饱和甘油酯与NaOH反应物质的量关系是解本题关键,注意:由酯的相对分子质量计算羧酸的摩尔质量时要加上生成水的量,为易错点.

 名校课堂系列答案
名校课堂系列答案| A. | MnO2 CuO FeO | B. | (NH4)2SO4 K2SO4 NH4Cl | ||
| C. | AgNO3 KNO3 Na2CO3 | D. | Na2CO3 NaHCO3 K2CO3 |
| A. | 在反应Cl2+2NaOH═NaCl+NaClO+H2O中,Cl2是氧化剂,NaOH是还原剂 | |
| B. | 在反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂 | |
| C. | 在反应NaH+H2O═NaOH+H2↑中,H2既是氧化物又是还原产物 | |
| D. | 在反应H2S+H2SO4═S↓+SO2↑+2H2O中SO2是氧化产物,S是还原产物 |
 物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是化学中间体.下列关于物质X的说法正确的是( )
物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是化学中间体.下列关于物质X的说法正确的是( )| A. | X分子式为C6H7O7 | |
| B. | 1 mol物质X可以和3 mol氢气发生加成 | |
| C. | X可以发生消去反应、取代反应等 | |
| D. | 1mol X分别与足量的NaHCO3、Na反应得到的气体体积比为3:2 |