题目内容
3.在0.3mol/L的硝酸银溶液500mL中加入200mL 1mol/L的氯化铁溶液,混合液中所含的离子浓度最大的是( )| A. | Cl- | B. | Ag+ | C. | NO3- | D. | Fe3+ |
分析 混合后溶液中Ag++Cl-=AgCl↓,Ag+和Cl-的浓度减小,计算溶液中铁离子和硝酸根离子再比较.
解答 解:混合后溶液中Ag++Cl-=AgCl↓,Ag+和Cl-的浓度减小,c(Cl-)=$\frac{1mol/L×3×0.2L-0.3mol/L×0.5L}{0.5L+0.2L}$=$\frac{4.5}{7}$mol/L;溶液中c(Fe3+)=$\frac{1mol/L×0.2L}{0.2L+0.5L}$=$\frac{2}{7}$mol/L,c(NO3-)=$\frac{0.3mol/L×0.5L}{0.2L+0.5L}$=$\frac{1.5}{7}$mol/L,所以混合液中所含的离子浓度最大的是Cl-,
故选A.
点评 本题考查了离子反应和物质的量浓度的计算,题目难度不大,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
14.能说明元素X的气态原子得电子能力比元素Y的气态原子得电子能力强的事实是( )
| A. | 元素周期表中X位于Y的上一周期 | |
| B. | X的含氧酸的酸性强于Y的含氧酸的酸性 | |
| C. | 将H2X、HY分别加热至500℃,只有HY发生分解 | |
| D. | Xn-的还原性强于Ym- |
11.下列有机反应中,不属于取代反应的是( )
| A. | CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| B. | 2CH3CH2OH+O2 $→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| D. | 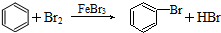 |
18.一定温度压强的理想气体,影响其所占体积大小的主要因素有( )
a.分子直径的大小 b.分子间距离的大小
c.分子间的引力大小 d.分子数目的大小.
a.分子直径的大小 b.分子间距离的大小
c.分子间的引力大小 d.分子数目的大小.
| A. | a、b | B. | b、c | C. | a、d | D. | b、d |
8.下列化合物的命名正确的是( )
| A. | 3,3-二甲基丁烷 | B. |  1-甲基-1-丙醇 1-甲基-1-丙醇 | ||
| C. |  甲基苯酚 甲基苯酚 | D. |  2-乙基-1-丁烯 2-乙基-1-丁烯 |
15.下列说法正确的是( )
| A. | L层上的电子数为奇数的元素一定是主族元素 | |
| B. | 族序数等于周期序数的元素一定是金属元素 | |
| C. | 由不同种元素组成的多原子分子里,一定只存在极性键 | |
| D. | 共价化合物只含有共价键,离子化合物只含有离子键 |
13.丙烯醇(CH2═CHCH2OH)可发生的化学反应有( )
①加成反应 ②氧化反应 ③燃烧 ④加聚反应 ⑤取代反应.
①加成反应 ②氧化反应 ③燃烧 ④加聚反应 ⑤取代反应.
| A. | ①②③④⑤ | B. | 只有①②③④ | C. | 只有①②③ | D. | 只有①③④ |
 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置: 氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置.
氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置.