题目内容
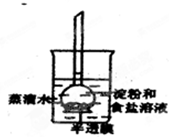 如图所示,烧杯内装有蒸馏水,下部封有半透膜的长颈漏斗内装有淀粉和食盐溶液,漏斗颈内的液面略高于烧杯内蒸馏水的液面,过一段时间后用碘水和硝酸银溶液分别检验蒸馏水中的物质.整个实验过程中,所观察到的现象是( )
如图所示,烧杯内装有蒸馏水,下部封有半透膜的长颈漏斗内装有淀粉和食盐溶液,漏斗颈内的液面略高于烧杯内蒸馏水的液面,过一段时间后用碘水和硝酸银溶液分别检验蒸馏水中的物质.整个实验过程中,所观察到的现象是( )| A、漏斗颈内液面下降 |
| B、漏斗颈内液面上升 |
| C、烧杯内液体遇硝酸银溶液没有白色沉淀生成 |
| D、烧杯内液体遇碘水变蓝 |
考点:实验装置综合,渗析
专题:实验题
分析:食盐即氯化钠,在水中电离出钠离子和氯离子,而离子可以透过半透膜,最终半透膜两侧的氯离子和钠离子浓度相同,但是淀粉不能透过半透膜,故实验最终渗透平衡时,漏斗内的溶液浓度高于烧杯内的溶液浓度,据此分析即可.
解答:
解:食盐电离出钠离子和氯离子,离子可以透过半透膜,最终半透膜两侧的氯离子和钠离子浓度相同,但是淀粉不能透过半透膜,故烧杯内的溶液遇碘水不变蓝,故实验最终渗透平衡时,漏斗内的溶液浓度高于烧杯内的溶液浓度,所以漏斗内液面上升,故选B.
点评:本题主要考查的是胶体的性质以及半透膜,熟练掌握已有的知识并灵活应用是关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 在如图所示的装置中,烧瓶中充满干燥的气体a,将滴管内的液体b挤入烧瓶内,轻轻振荡烧瓶,并打开弹簧夹,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别可能是( )
在如图所示的装置中,烧瓶中充满干燥的气体a,将滴管内的液体b挤入烧瓶内,轻轻振荡烧瓶,并打开弹簧夹,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别可能是( )| A、NO2和水 |
| B、SO2和NaOH溶液 |
| C、NH3和稀盐酸 |
| D、Cl2和饱和NaCl溶液 |
下列有关溶液组成的描述合理的是( )
| A、弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- |
| B、酸性溶液中可能大量存在Na+、ClO-、SO42-、I- |
| C、常温下在c(H+)=1×10-13 mol?L-1的溶液中能大量存在Mg2+、Cu2+、SO42-、NO3- |
| D、加入铝粉能产生氢气的溶液中大量存在NH4+、Fe2+、SO42-、NO3- |


 如图装置,在关闭活塞K时通入气体X,b中溶液没有明显现象;开启活塞K通入气体X,则b中溶液有明显现象,下列判断中合理的是( )
如图装置,在关闭活塞K时通入气体X,b中溶液没有明显现象;开启活塞K通入气体X,则b中溶液有明显现象,下列判断中合理的是( )

