题目内容
焦亚硫酸钠的制取采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5.装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2═Na2S2O5

(1)装置I中产生气体的化学方程式为 .
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 .
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 (填序号).

(1)装置I中产生气体的化学方程式为
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为

考点:制备实验方案的设计
专题:实验设计题
分析:(1)装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤操作;
(3)装置Ⅲ用于处理尾气,吸收为反应的二氧化硫,应防止倒吸,且不能处于完全密闭环境中.
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤操作;
(3)装置Ⅲ用于处理尾气,吸收为反应的二氧化硫,应防止倒吸,且不能处于完全密闭环境中.
解答:
解:(1)装置Ⅰ中亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤进行分离,
故答案为:过滤;
(3)a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故错误;
c.该装置不能吸收二氧化硫,所以无法实现实验目的,故错误;
d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故正确;
故答案为:d.
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤进行分离,
故答案为:过滤;
(3)a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故错误;
c.该装置不能吸收二氧化硫,所以无法实现实验目的,故错误;
d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故正确;
故答案为:d.
点评:本题考查物质的制备实验、实验方案设计,为高频考点,侧重于学生的分析能力、实验能力的考查,难度中等,明确实验原理是解本题关键,根据物质的性质分析解答,注意元素化合物知识的积累和灵活运用.

练习册系列答案
相关题目
下列化学实验事实及其解释都正确的是( )
| A、将饱和氯水滴到淀粉碘化钾试纸上,如果试纸先变蓝后变白,说明氯水具有漂白性 |
| B、将SO2通入含HClO的溶液中,生成H2SO4说明HClO酸性比H2SO4强 |
| C、铁钉放在浓硝酸中浸泡后,在用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化铜 |
| D、FeCl3溶液可与腐蚀线路板上的Cu,说明Fe的金属活性大于Cu |
用石墨电极电解100mLH2SO4与CuSO4的混合溶液,通电一段时间后,阴、阳极两极分别收集到2.24L和3.36L气体(标准状况),溶液要想恢复电解前的状态可加入下列( )
| A、0.1molCuO |
| B、0.1molCuCO3 |
| C、0.1molCu(OH)2 |
| D、0.1molCu2(OH)2CO3 |
 如图装置,将液体A逐滴加入固体B中,下列叙述正确的是( )
如图装置,将液体A逐滴加入固体B中,下列叙述正确的是( )| A、若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
| B、若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中溶液变浑浊 |
| C、若A为浓氨水,B为生石灰,C中盛A1C13溶液,则C中先产生白色沉淀后沉淀又溶解 |
| D、实验仪器D可以起到防止溶液倒吸的作用 |
下列说法正确的是( )
| A、用10mL量筒量取7.8mL浓H2SO4 |
| B、用碱式滴定管量取18.20mLKMnO4溶液 |
| C、酸碱中和滴定时,滴定管和锥形瓶需分别用标准液和待测液润洗 |
| D、读取标准液读数时,若滴定前仰视,滴定后俯视,会导致测定结果偏低 |
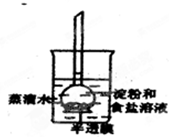 如图所示,烧杯内装有蒸馏水,下部封有半透膜的长颈漏斗内装有淀粉和食盐溶液,漏斗颈内的液面略高于烧杯内蒸馏水的液面,过一段时间后用碘水和硝酸银溶液分别检验蒸馏水中的物质.整个实验过程中,所观察到的现象是( )
如图所示,烧杯内装有蒸馏水,下部封有半透膜的长颈漏斗内装有淀粉和食盐溶液,漏斗颈内的液面略高于烧杯内蒸馏水的液面,过一段时间后用碘水和硝酸银溶液分别检验蒸馏水中的物质.整个实验过程中,所观察到的现象是( )| A、漏斗颈内液面下降 |
| B、漏斗颈内液面上升 |
| C、烧杯内液体遇硝酸银溶液没有白色沉淀生成 |
| D、烧杯内液体遇碘水变蓝 |
下列实验设计能够成功的是( )
A、检验亚硫酸钠试样是否变质:试样
| ||||||||
B、从氧化铝、二氧化硅混合物中提取氧化铝:氧化铝(二氧化硅)
| ||||||||
C、除去氯化钠晶体中少量硝酸钾:试样
| ||||||||
D、从含有Ca2+、SO42-的粗盐中提取NaCl:粗盐水
|
 检查装置气密性是化学实验中的重要操作之一.按要求回答下列问题:
检查装置气密性是化学实验中的重要操作之一.按要求回答下列问题: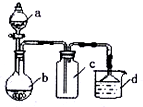 实验室某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).用此装置和表中提供的物质完成相关实验,最合理的选项是( )