题目内容
18.下列叙述正确的是( )| A. | 100mL1mol/L的Na2CO3溶液中含有6.02×1022个CO32- | |
| B. | 足量铁粉在0.05molC12中充分燃烧,反应时转移6.02x1022个电子 | |
| C. | 将4gNaOH溶于100g蒸馏水,所得溶液物质的量浓度是1mol/L | |
| D. | 常温下,将9g铝片投入500mL18.4mol•L-1的硫酸中,产生H2比11.2L多 |
分析 A、碳酸根离子是弱离子;
B、氯气与铁反应生成氯化铁,1mol的氯气转移2mol的电子,所以0.05molC12转移电子的物质的量为0.05×2=0.1mol;
C、溶液体积不明确;
D、铝与浓硫酸发生钝化.
解答 解:A、碳酸根离子是弱离子要水解,所以100mL1mol/L的Na2CO3溶液中含有CO32-小于6.02×1022个,故A错误;
B、氯气与铁反应生成氯化铁,1mol的氯气转移2mol的电子,所以0.05molC12转移电子的物质的量为0.05×2=0.1mol,所以反应时转移6.02x1022个电子,故B正确;
C、溶液体积不明确,故所得氢氧化钠溶液的浓度无法计算,故C错误;
D、铝与浓硫酸发生钝化,不产生氢气,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的性质是解题关键,学生注意18.4mol•L-1的硫酸是浓硫酸,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.某学生做如下实验:第一步,在淀粉KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失.下列叙述中对实验原理的解释和结论不正确的是( )
| A. | 氧化性:HClO>I2>SO42- | |
| B. | 淀粉KI溶液变蓝是因为I-被氧化为I2,淀粉遇I2变蓝 | |
| C. | 第二步蓝色消失的反应中1mol氧化剂失去电子的数目为2NA | |
| D. | 若将Na2SO3溶液加入氯水中,氯水褪色 |
13.某无色透明溶液,能与铝作用放氢气,则此溶液中一定可以大量共存的离子组是( )
| A. | K+、Na+、Cl- | B. | K+、Cu2+、SO42- | C. | Cl-、NO3-、Mg2+ | D. | Ba2+、SO42-、Na+ |
3.下列对硫酸的叙述正确的是( )
| A. | 因浓硫酸具有强氧化性,故不可用它来干燥氢气 | |
| B. | 浓硫酸不活泼,可用铁铝容器存放 | |
| C. | 浓硫酸有强氧化性,稀硫酸没有氧化性 | |
| D. | 浓硫酸难挥发,可用来制HF、HCl等挥发性酸 |
3.在20℃时某化学反应的速率为0.15mol•L-1•s-1,若温度每升高5℃,反应速率提高到原来的2倍,则为使反应速率达到1.2mol•L-1•s-1,应使反应在什么温度下进行( )
| A. | 30℃ | B. | 35℃ | C. | 40℃ | D. | 45℃ |
1.氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2+O2═2H2O,正极反应为:O2+2H2O+4e-═4OH-,下列叙述不正确的是( )
| A. | H2通入负极区 | B. | O2通入正极区 | ||
| C. | 负极反应为2H2+4OH--4e-═4H2O | D. | 正极发生氧化反应 |
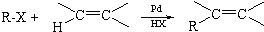


 ;F→G:
;F→G: .
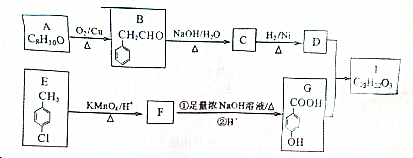
. .
.
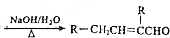
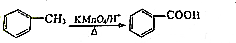
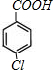 +3 NaOH$\stackrel{△}{→}$
+3 NaOH$\stackrel{△}{→}$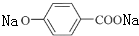 +NaCl+2H2O.
+NaCl+2H2O. (无机试剂任用).合成路线流程图示例如下:
(无机试剂任用).合成路线流程图示例如下: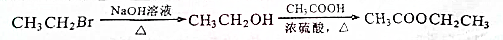
 .C2A4的水溶液呈碱(填“酸”“碱”或“中”)性,1mol C2A4最多可以与2mol HCl或NaOH发生中和反应生成正盐.C2A4 和A2D2 既具有氧化性,又具有还原性,从化合价的角度解释C2A4 和A2D2 既具有氧化性又具有还原性的原因N2H4中N显-2,H2O2中O显-1,均为相应元素的中间价态,所以既有氧化性,又有还原性
.C2A4的水溶液呈碱(填“酸”“碱”或“中”)性,1mol C2A4最多可以与2mol HCl或NaOH发生中和反应生成正盐.C2A4 和A2D2 既具有氧化性,又具有还原性,从化合价的角度解释C2A4 和A2D2 既具有氧化性又具有还原性的原因N2H4中N显-2,H2O2中O显-1,均为相应元素的中间价态,所以既有氧化性,又有还原性 ,该化合物与CA3和A2D的熔点由高到低的顺序为H2O>NH3>CH4(用化学式表示).
,该化合物与CA3和A2D的熔点由高到低的顺序为H2O>NH3>CH4(用化学式表示). .CA3、A2D、EA3的热稳定性由强到弱的顺序为H2O>NH3>PH3(用化学式表示).
.CA3、A2D、EA3的热稳定性由强到弱的顺序为H2O>NH3>PH3(用化学式表示).