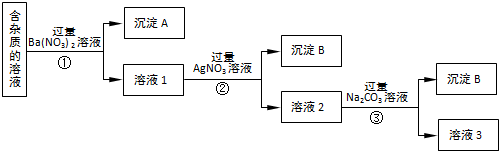
题目内容
5.同温同压下,等体积的两个密闭容器分别装有12C18O和14N2两种气体,关于这两个容器中气体的说法不正确的是( )| A. | 质子数相等,质量不相等 | B. | 质子数、质量都不相等 | ||
| C. | 分子数、质量分别相等 | D. | 原子数、电子数都相等 |
分析 同温同压下,等体积的两个密闭容器中分别装有12C18O和14N2两种气体,则两种气体的物质的量相同、分子数目相等,每个分子均含有14个质子、14个电子,则含有质子数、电子数相等,二者摩尔质量不相等,则二者质量不相等.
解答 解:同温同压下,等体积的两个密闭容器中分别装有12C18O和14N2两种气体,则两种气体的物质的量相同、分子数目相等.
A.12C18O和14N2分子均含有14个质子,则含有质子数相等,二者摩尔质量分别为30g/mol、28g/mol,根据m=nM可知二者质量不相等,故A正确;
B.二者含有质子数相等,二者质量不相等,故B错误;
C.二者含有分子数相等,二者质量相等,故C正确;
D.均为双原子分子,二者含有原子数目相等,每个分子均含有14个电子,二者含有电子数相等,故D正确.
故选:B.
点评 本题考查阿伏加德罗定律、微粒数目计算,解题的关键是把握原子的结构特点,掌握质量数与质子数、中子数关系.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
15.在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | Fe$\stackrel{稀H_{2}SO_{4}}{→}$FeSO4(aq)$\stackrel{NaOH(aq)}{→}$Fe(OH)2 | |
| B. | Al3+$\stackrel{过量氨水}{→}$Al${\;}_{2}^{-}$$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| C. | NH3$\stackrel{O_{2}}{→}$NO$\stackrel{H_{2}O}{→}$HNO3 | |
| D. | 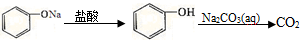 |
16.下列说法正确的是( )
| A. | 难失去电子的原子,易形成阴离子 | |
| B. | 只有化合物分子中才存在共价键 | |
| C. | 共价分子中所有原子都具有8电子稳定结构 | |
| D. | 含氧酸的组成中可以含有金属元素 |
20.X元素的离子X2-,核外电子数为m,中子数为n,wg X的氢化物中的电子为( )
| A. | $\frac{W}{m+n+2}$×m mol | B. | $\frac{W}{m+n}$×m mol | C. | $\frac{W}{m+n+2}$×(m+2)mol | D. | $\frac{W}{m+n}$×(m-2)mol |
5.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示:
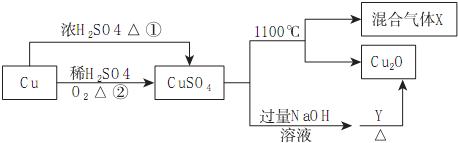
下列说法正确的是( )

下列说法正确的是( )
| A. | 途径①和途径②都体现了硫酸的酸性和氧化性 | |
| B. | Y可以是乙醛溶液 | |
| C. | CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| D. | 将CuSO4溶液蒸发浓缩、冷却结晶,可制得胆矾晶体 |
3.下列离子方程式正确的是( )
| A. | 向氢氧化钠溶液中滴加醋酸:H++OH-═H2O | |
| B. | 碳酸氢钙溶液中加入氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| C. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| D. | 在氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
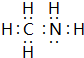 .
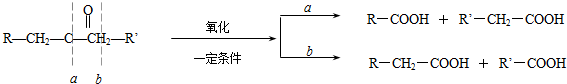
.
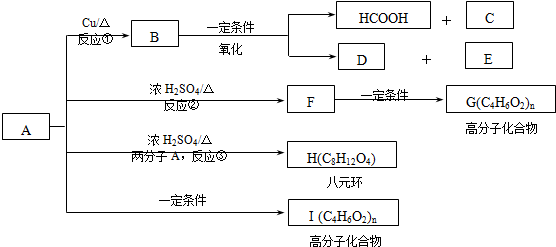
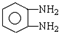 )生成一种合成纤维:
)生成一种合成纤维: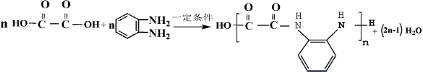 .
.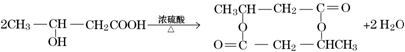 .
.