题目内容
14.下列叙述正确的是( )| A. | 高温下Fe与水蒸气反应可生成Fe3O4和H2 | |
| B. | Cu与冷的浓硫酸因发生钝化,反应难以进行 | |
| C. | Na2O、Na2O2与CO2反应,产物均相同 | |
| D. | 向AlCl3溶液中逐滴加氨水,产生白色沉淀,过量时,沉淀消失 |
分析 A.Fe与水蒸气发生氧化还原反应;
B.Cu与冷的浓硫酸不反应;
C.Na2O与CO2反应生成碳酸钠,Na2O2与CO2反应生成碳酸钠和氧气;
D.向AlCl3溶液中逐滴加氨水生成氢氧化铝沉淀,沉淀不溶于弱碱溶液.
解答 解:A.Fe与水蒸气发生氧化还原反应,生成Fe3O4和H2,故A正确;
B.Cu与冷的浓硫酸不反应,加热时发生氧化还原反应生成硫酸铜、二氧化硫,不发生钝化,故B错误;
C.Na2O与CO2反应生成碳酸钠,Na2O2与CO2反应生成碳酸钠和氧气,则反应产物不完全相同,故C错误;
D.向AlCl3溶液中逐滴加氨水生成氢氧化铝沉淀,沉淀不溶于弱碱溶液,则氨水过量时沉淀不消失,故D错误;
故选A.
点评 本题考查常见金属及化合物的性质,为高频考点,把握物质的性质、发生的反应为解答的关键,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
相关题目
6.下列过程或操作变化:①分馏②裂化③裂解④萃取⑤渗析⑥变性⑦盐析其中属于化学变化的是( )
| A. | 只有②③ | B. | ①②⑦ | C. | ①③⑥ | D. | ②③⑥ |
5.在水溶液里或熔融状态下能导电的化合物是电解质.下列物质不属于电解质的是( )
| A. | Cu | B. | NaOH | C. | H2SO4 | D. | Na2SO4 |
9.将agFe2O3、Al2O3样品溶解在过量的200mL浓度为0.1mol•L-1的盐酸溶液中,然后向其中加入NaOH溶液,使Al3+、Fe3+刚好完全沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为( )
| A. | 0.1 mol/L | B. | 0.2 mol/L | C. | 0.4 mol/L | D. | 0.6mol/L |
19.下列关于化学反应速率的叙述正确的是( )
| A. | 在可逆反应中,正反应的化学反应速率是正值,逆反应的化学反应速率是负值 | |
| B. | 化学反应速率为0.8 mol•L-1•s-1是指1秒钟时某物质的浓度为0.8 mol•L-1 | |
| C. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| D. | 化学反应的速率可以是g•(L•s)-1,也可以是kg•(L•s)-1,甚至可以用t•(L•s)-1表示 |
6.下列说法中正确的是( )
| A. | 氧化还原反应的实质是相互交换成分 | |
| B. | 在氧化还原反应中,化合价变化的一定是不同元素 | |
| C. | 在氧化还原反应中,氧化剂与还原剂一定是不同物质 | |
| D. | 某元素由游离态转化为化合态,这种元素不一定被氧化了 |
3.在密闭容器中发生可逆反应4NH3+5O2?4NO+6H2O(g),以下是不同情况下的反应速率,其中最快的是( )
| A. | v(O2)=0.001mol/(L•S) | B. | v(NH3)=0.002 mol/(L•S) | ||
| C. | v(H2O)=0.003 mol/(L•h) | D. | v(NO)=0.008 mol/(L•S) |
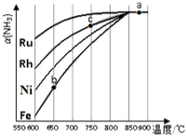 氨气在生产、生活和科研中应用十分广泛.
氨气在生产、生活和科研中应用十分广泛.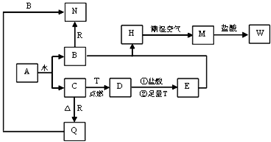 已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体.
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体.