题目内容
下列说法正确的是( )
| A、某微粒空间构型为直线形,则该微粒一定是非极性分子 |
| B、某微粒空间构型为V形,则中心原子一定是sp3杂化 |
| C、某微粒空间构型为平面三角形,则中心原子一定是sp2杂化 |
| D、某微粒空间构型为正四面体,则键角一定是109°28’ |
考点:判断简单分子或离子的构型,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:A、结构对称,正负电荷中心重叠的分子为非极性分子;
B、若为sp2杂化,有一个孤电子对时也是V形;
C、若为sp2杂化,而且没有孤电子对时是平面三角形;
D、某微粒空间构型为正四面体,则键角不一定是109°28′.
B、若为sp2杂化,有一个孤电子对时也是V形;
C、若为sp2杂化,而且没有孤电子对时是平面三角形;
D、某微粒空间构型为正四面体,则键角不一定是109°28′.
解答:
解:A、结构对称,正负电荷中性重叠的分子为非极性分子,如HCl为直线形分子,由于分子结构不对称,正负电荷中心不重叠为极性分子,故A错误;
B、若中心原子是sp3杂化,而且含有2个孤电子对,则微粒空间构型为V形,若为sp2杂化,有一个孤电子对时,微粒空间构型也是V形,故B错误;
C、若为sp2杂化,而且没有孤电子对时是平面三角形,则某微粒空间构型为平面三角形,则中心原子一定是sp2杂化,故C正确;
D、某微粒空间构型为正四面体,则键角不一定是109°28′,如白磷为正四面体结构图为 ,分子中P-P键的键角为60°,故D错误.
,分子中P-P键的键角为60°,故D错误.
故选C.
B、若中心原子是sp3杂化,而且含有2个孤电子对,则微粒空间构型为V形,若为sp2杂化,有一个孤电子对时,微粒空间构型也是V形,故B错误;
C、若为sp2杂化,而且没有孤电子对时是平面三角形,则某微粒空间构型为平面三角形,则中心原子一定是sp2杂化,故C正确;
D、某微粒空间构型为正四面体,则键角不一定是109°28′,如白磷为正四面体结构图为
 ,分子中P-P键的键角为60°,故D错误.
,分子中P-P键的键角为60°,故D错误.故选C.
点评:本题考查了分子极性的判断、杂化类型和分子空间结构的判断,题目难度不大,注意把握杂化类型的判断方法.

练习册系列答案
相关题目
分子式为C8H10O的芳香族化合物能与钠反应放出氢气,则其可能结构有( )
| A、10种 | B、12种 |
| C、14种 | D、19种 |
在密闭容器中,加入3mol A和1mol B,一定条件下发生反应3A(g)+B(g)?2C(g)+D(g),达平衡时,测得C的浓度为w mol/L,若保持容器中容积和温度不变,重新按下列配比作起始物质,达到平衡时,C的浓度仍然为w mol/L的是( )
| A、6molA+2molB |
| B、1.5molA+0.5molB+1molC+0.5molD |
| C、3molA+1molB+2molC+1molD |
| D、1molB+2molC+1molD |
向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )
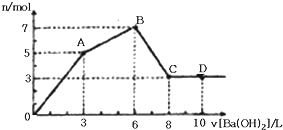

| A、OA段反应的离子方程式为:3Ba2++2Al3++8OH-+3SO42-═3BaSO4↓+2AlO2-+4H2O |
| B、向D点溶液中通入C02气体,立即产生白色沉淀 |
| C、原混合液中c[Al2(SO4)3]:c(AlCl3)═1:2 |
| D、图中C点铝元素存在形式是AlO2- |
下列说法正确的是( )
| A、在氧化还原反应中,金属单质只体现还原性,金属阳离子只体现氧化性 |
| B、按金属活动性顺序,排在前面的金属一定可以把排在后面的金属从它们的盐溶液中置换出来 |
| C、考虑到成本问题,工业上将氯气通入澄清石灰水中制取漂白粉 |
| D、液态(熔融)HCl不导电,但是HCl的水溶液可以导电,所以HCl是电解质 |
下列各组顺序的排列不正确的是( )
| A、离子半径:F->Na+>Mg2+>Al3+ |
| B、热稳定性:HCl>H2S>PH3>AsH3 |
| C、酸性强弱:H3AlO3<H4SiO4<H2CO3<H3PO4 |
| D、沸点:HF<HCl<HBr<HI |
下列关于维生素C的说法错误的是( )
| A、维生素C是水溶性的,在洗菜时容易损失 |
| B、维生素C怕高温,加热时间过长会破坏 |
| C、维生素C具有还原性,含维生素C的蔬菜存放的时间越长,维生素C的损失越大 |
| D、水溶性维生素不易被人体吸收,所以容易缺乏 |
下列物质的性质(或性质递变规律)与键能有关的是( )
| A、F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
| B、NH3易液化 |
| C、HF、HCl、HBr、HI的热稳定性依次减弱 |
| D、H2S的熔沸点低于H2O的熔、沸点 |