题目内容
已知X、Y中含有相同的元素,Z、W中也含有相同的元素,根据反应X+H2O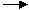 Y+H2
Y+H2 ↑;Z+H2O
↑;Z+H2O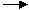 W+O2↑(方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高低顺序为( )
W+O2↑(方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高低顺序为( )
| A.X>Y Z>W | B.X<Y Z<W |
| C.X>Y Z<W | D.X<Y Z>W |
D
解析试题分析:根据题意可知:X是钠,Y是氢氧化钠,Z是过氧化钠W分别氢氧化钠。X、Y中含有相同的元素是钠,在其中钠元素的化合价分别是0价、+1价;Z、W中含有相同的元素是氧,在其中氧元素的化合价分别是-1价、-2价,所以化合价的高低顺序为X<Y Z>W。
考点:考查钠单质及其化合物的性质等知识。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
称取两份铝粉,第一份中加入足量的盐酸,第二份中加入足量的烧碱,若同温同压下放出相同体积的气体,则两份铝粉的质量比为
| A.2∶3 | B.1∶6 | C.3∶2 | D.1∶1 |
下列说法不正确的是( )
| A.干燥的氯气可以用钢瓶运输 |
| B.钠可以保存在CCl4液体中(已知:密度CCl4 > Na) |
| C.Na2O2可作为潜水艇的供氧剂 |
| D.实验后剩余的钠粒可放回原试剂瓶中 |
某同学通过系列实验探究Mg及其化合物的性质, 操作正确且能达到目的的是
操作正确且能达到目的的是
| A.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 |
| B.将水加入浓硫酸中得到稀硫酸,置镁片于其中探究讨Mg的活泼性 |
| C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 |
| D.将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体 |
将ag镁铝合金投入到x mL 2mol/L的盐酸中,金属完全溶解后,再加入y mL 1mol/L的氢氧化钠溶液,得到的沉淀量最大,质量为(a+1.7)g。下列说法不正确的是
| A.镁铝合金与盐酸反应转移电子总数为0.lNA | B.x=2y |
| C.沉淀是Mg(OH)2和Al(OH)3的混合物 | D.2x=y |
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是
| A.合金的熔点一般比组分金属低 |
| B.铝钠合金若投入一定量的水中可得无色溶液,则n(Al)≤n(Na) |
| C.铝钠合金投入到足量氯化铜溶液中,会有氢氧化铜沉淀也可能有铜析出 |
| D.若m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小 |
(本题共13分)甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 | 操作 | 现象 |
| Ⅰ | 向2mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色,并有少量刺激性气味的气体逸出 |
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,请用化学平衡移动原理解释溶液呈红褐色的原因:________。
② 乙同学认为可能是发生了氧化还原反应,其中Fe3+ →Fe2+ ;请写出Fe3+ 跟SO32-反应的离子方程式
______________。
乙同学查阅资料得知:
1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3;
2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| Ⅱ | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| Ⅲ | 向1 mol?L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| Ⅳ | 用激光笔照射步骤Ⅲ中的红褐色溶液 | 没有出现“丁达尔效应” |
a.K3[Fe(CN)6] 溶液 b.KSCN溶液 c.KMnO4溶液
② 请用离子方程式和必要的文字说明步骤Ⅲ中出现红褐色的原因 。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
 Cu(NO3)2 乙:Cu
Cu(NO3)2 乙:Cu 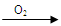 CuO
CuO