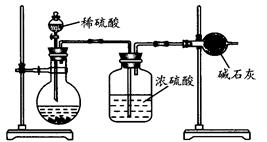
题目内容
将ag镁铝合金投入到x mL 2mol/L的盐酸中,金属完全溶解后,再加入y mL 1mol/L的氢氧化钠溶液,得到的沉淀量最大,质量为(a+1.7)g。下列说法不正确的是
| A.镁铝合金与盐酸反应转移电子总数为0.lNA | B.x=2y |
| C.沉淀是Mg(OH)2和Al(OH)3的混合物 | D.2x=y |
B
解析试题分析:A、沉淀量最大,说明沉淀是Mg(OH)2和Al(OH)3的混合物,所以混合物含有的OH-的质量为1.7g,物质的量=1.7g÷17g/mol=0.1mol。镁铝合金提供的电子等于混合物中OH-所带的电量,所以镁铝合金与盐酸反应转移电子总数为0.1mol×NAmol-1=0.NA,故A正确;B、加入氢氧化钠后,最终溶液为氯化钠溶液,根据氯离子、钠离子守恒可知n(HCl)=n(NaCl)=n(NaOH),所以x mL×2mol/L=y mL×1mol/L,即y=2x,故B错误;C、氢氧化镁、氢氧化铝不溶于水,得到的沉淀量最大,氢氧化铝没有与氢氧化钠反应,沉淀是Mg(OH)2和Al(OH)3的混合物,故C正确;D、由B中分析可知,y=2x,故D正确,答案选B。
考点:考查镁铝性质以及混合物的有关计算

练习册系列答案
相关题目
向一定量的饱和NaOH溶液中加入少量Na2O固体,恢复到原来温度时,下列说法中正确的是( )
| A.溶液中的Na+总数不变 | B.溶液中的OH-数目不变 |
| C.溶质的物质的量浓度不变 | D.溶液的质量不变 |
下列有关常见金属及其化合物的说法正确的是:
| A.氯化铁溶液中加入还原性铁粉无明显颜色变化 |
| B.铁与水蒸气在高温下的反应产物为Fe2O3和H2 |
| C.AlCl3与过量NaOH溶液反应生成AlO2-,则与过量NH3·H2O也生成AlO2- |
| D.常温下1 mol铜片投入含4 mol HNO3的浓硝酸中金属可完全溶解 |
Al、Fe、Cu都是重要的金属元素。下列说法正确的是
| A.三者对应的氧化物均为碱性氧化物 |
| B.三者的单质放置在空气中均只生成氧化物 |
C.制备AlCl3、Fe Cl3、CuCl2均不能采用将溶液直接蒸干的方法 Cl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| D.AlCl3、FeCl3、CuCl2均可用作净水剂 |
已知X、Y中含有相同的元素,Z、W中也含有相同的元素,根据反应X+H2O Y+H2
Y+H2 ↑;Z+H2O
↑;Z+H2O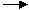 W+O2↑(方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高低顺序为( )
W+O2↑(方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高低顺序为( )
| A.X>Y Z>W | B.X<Y Z<W |
| C.X>Y Z<W | D.X<Y Z>W |
将ag Mg、Al合金完全溶解在V1L、c1mol/L的盐酸溶液中,产生bgH2。再向反应后的溶液中加入V2L,c2mol/LNaOH溶液,恰好使沉淀达到最大值,且沉淀质量为dg。则下列关系式错误的是( )
| A.合金中的物质的量为(24b-a)/9mol |
| B.d=a+17b |
C.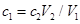 |
D.与金属反应后剩余盐酸的物质的量浓度为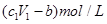 |