题目内容
12.钓鱼岛的东海海域及部分太平洋海域探明为海底热水矿床,含有许多金属及其化合物.有关金属冶炼的反应原理错误的是高温( )| A. | Al2O3+3H2 $\frac{\underline{\;\;△\;\;}}{\;}$2Al+3H2O | B. | Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2 | ||
| C. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 | D. | 2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑ |
分析 属冶炼是工业上将金属从含有金属元素的矿石中还原出来的生产过程.金属的活动性不同,可以采用不同的冶炼方法.
金属冶炼的方法主要有:
热分解法:对于不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来(Hg及后边金属);
热还原法:在金属活动性顺序表中处于中间位置的金属,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来(Zn~Cu);
合电解法:活泼金属较难用还原剂还原,通常采用电解熔融的金属化合物的方法冶炼活泼金属(K~Al).
解答 解:A.铝的冶炼是电解熔融氧化铝得到,故A错误;
B.硫化亚铜和氧气反应生成铜,属于冶炼金属的方法,故B正确;
C.铁是利用热还原法冶炼Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 ,原理正确,故C正确;
D.银的冶炼是利用氧化物的热分解方法得到,故D正确;
故选A.
点评 本题考查了金属冶炼的一般原理,难度不大,注意根据金属的活泼性不同采取相应的冶炼方法.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
2.下列叙述不正确的是( )
| A. | 氢气在氯气中安静燃烧,发出苍白色火焰,瓶口出现的“雾气”是盐酸小液滴 | |
| B. | 漂白粉溶液中滴入少量盐酸,可增强其漂白效果 | |
| C. | 钠在空气中燃烧,产生黄色火焰,生成白色的Na2O的固体 | |
| D. | 铁丝在氯气中燃烧,生产棕红色的烟,氯化铁的水溶液呈黄色 |
3.关于SO2性质和现象的对应描述,正确的是( )
| A. | SO2具有氧化性,能使品红溶液褪色 | |
| B. | SO2具有漂白性,能使溴水褪色 | |
| C. | SO2具有还原性,能与Ba(NO3)2溶液反应生成沉淀 | |
| D. | SO2具有漂白性,能使滴加酚酞的NaOH溶液由红色变为无色 |
20.铅蓄电池是常见的二次电池,电池总反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O.下列说法正确的是( )
| A. | 放电时PbO2发生氧化反应 | |
| B. | 充电时电解质溶液的质量减少 | |
| C. | 放电时的负极反应式为Pb+SO42--2e-=PbSO4 | |
| D. | 充电时的阴极反应式为PbSO4+2H2O-2e-=PbO2+SO42-+4H+ |
7.按照物质的树状分类和交叉分类,氯水应属于( )
①酸 ②能导电 ③胶体 ④混合物 ⑤化合物 ⑥溶液 ⑦电解质.
①酸 ②能导电 ③胶体 ④混合物 ⑤化合物 ⑥溶液 ⑦电解质.
| A. | ①②④⑥⑦ | B. | ①②⑤⑦ | C. | ②④⑥ | D. | ②④⑥⑦ |
17.下列实验能达到预期目的是( )
| 编号 | 实验内容 | 实验目的 |
| A | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| B | 室温下,用pH试纸分别测定浓度为18mol/L和0.1mol/L H2SO4溶液的pH | 比较不同浓度H2SO4的酸性强弱 |
| C | 配制FeCl2溶液时,先将FeCl2溶于适量浓盐酸中,再用蒸馏水稀释到所需浓度,最后在试剂瓶中加入少量铜粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
| D | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp>Ksp |
| A. | A | B. | B | C. | C | D. | D |
4. 已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
请根据信息回答有关问题:
(1)写出元素Y的原子核外价电子排布图: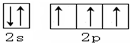 .X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.
.X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号)N>O>C.
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式)H2O,原因是水分子间可以形成氢键,使沸点升高.
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式:C≡O.
(5)R的一种配合物的化学式为RCl3•6H2O.已知0.01mol RCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2OD.[R(H2O)3Cl3]•3H2O
(6)向含少量ESO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,反应的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,继续滴加氨水至过量,沉淀溶解,
得到天蓝色溶液,写反应的离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
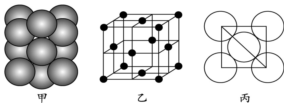
(7)元素E的单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.
若已知该元素的原子半径为d cm,相对原子质量为M,NA代表阿伏加德罗常数,则该晶体的密度为$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3(用字母表示).
 已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数 |
| Y | 原子核外的L层有3个未成对电子 |
| Z | 地壳中含量最多的元素 |
| Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | N能层上只有一个电子,K、L、M层均排满电子 |
(1)写出元素Y的原子核外价电子排布图:
 .X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.
.X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号)N>O>C.
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式)H2O,原因是水分子间可以形成氢键,使沸点升高.
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式:C≡O.
(5)R的一种配合物的化学式为RCl3•6H2O.已知0.01mol RCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2OD.[R(H2O)3Cl3]•3H2O
(6)向含少量ESO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,反应的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,继续滴加氨水至过量,沉淀溶解,
得到天蓝色溶液,写反应的离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
(7)元素E的单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.
若已知该元素的原子半径为d cm,相对原子质量为M,NA代表阿伏加德罗常数,则该晶体的密度为$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3(用字母表示).
1.五种短周期元素在元素周期表中的位置如表所示,其中X元素最高正化合价与最低负化合价的代数和为0,下列判断不正确的是( )
| X | |||||
| Z | Y | M | N |
| A. | N的氧化物对应水化物的酸性一定比X的氧化物对应水化物的酸性强 | |
| B. | 相同条件下,与同浓度、同体积的盐酸反应,单质Z的反应速率大于单质Y | |
| C. | X的原子半径比Y的小 | |
| D. | X和M的原子序数相差10 |
2.图所示的实验装置图正确且能达到相应实验目的是( )
| A. | 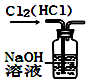 用图所示装置除去Cl2中的HCl | |
| B. | 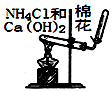 用图所示装置实验室制NH3 | |
| C. | 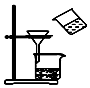 用图所示装置分离MnO2和KCl | |
| D. | 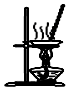 用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |