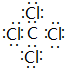题目内容
12.Cl2、Br2、I2都具有氧化性,其氧化性Cl2>Br2>I2,Cl2能把溴从溴化物中置换出来,其余类推.(1)实验室用MnO2制备Cl2的反应中氧化剂是MnO2,氧化产物是Cl2.将17.4g MnO2 与足量的浓盐酸反应,则被氧化的HCl的物质的量为0.4mol.
(2)将溴水滴入KI溶液中的化学方程式为2KI+Br2═2KBr+I2.
分析 (1)n(MnO2)=$\frac{17.4g}{87g/mol}$=0.2mol,反应方程式为MnO2+4HCl (浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,根据方程式计算相关物理量;
(2)将溴水滴入KI溶液中生成碘单质和溴化钾,反应的化学方程式为:2KI+Br2═2KBr+I2.
解答 解:(1)实验室用MnO2制备Cl2的反应中,锰的化合价降低,是氧化剂,氯的化合价升高,所以氯气是氧化产物,
MnO2+4HCl (浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O
1 4 1 1
0.2mol n(HCl) n(MnCl2) n(Cl2)
所以被氧化的HCl的物质的量为:2n(Cl2)=0.2mol×2=0.4mol,
故答案为:MnO2; Cl2;0.4mol;
(2)将溴水滴入KI溶液中生成碘单质和溴化钾,反应的化学方程式为:2KI+Br2═2KBr+I2,故答案为:2KI+Br2═2KBr+I2.
点评 本题考查化学方程式的相关计算和化学方程式的书写,题目难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
3. 化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:
化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:
(1)已知C(s)+H2O(g)?CO(g)+H2(g),则该反应的平衡常数表达式为$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$.
(2)已知在一定温度下,
C(s)+CO2(g)?2CO(g)△H1
CO(g)+H2O(g)?H2(g)+CO2(g)△H2
C(s)+H2O(g)?CO(g)+H2(g)△H3
则△H1、△H2、△H3之间的关系是:△H3=△H1+△H2或△H1=△H3-△H2或△H2=△H3-△H1.
(3)通过研究不同温度下平衡常数可以解决某些实际问题.已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示.
则该反应的正反应方向是放热反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为75%.
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图1所示.下列说法正确的是E:
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
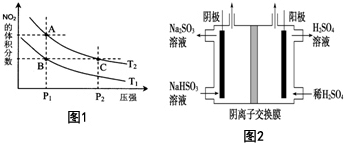
(5)工业上用Na2SO3吸收尾气中的SO2,再用图2装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为:HSO3-+H2O-2e-=SO42-+3H+,阳极区逸出气体的成分为O2、SO2(填化学式).
 化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:
化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:(1)已知C(s)+H2O(g)?CO(g)+H2(g),则该反应的平衡常数表达式为$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$.
(2)已知在一定温度下,
C(s)+CO2(g)?2CO(g)△H1
CO(g)+H2O(g)?H2(g)+CO2(g)△H2
C(s)+H2O(g)?CO(g)+H2(g)△H3
则△H1、△H2、△H3之间的关系是:△H3=△H1+△H2或△H1=△H3-△H2或△H2=△H3-△H1.
(3)通过研究不同温度下平衡常数可以解决某些实际问题.已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示.
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图1所示.下列说法正确的是E:
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
(5)工业上用Na2SO3吸收尾气中的SO2,再用图2装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为:HSO3-+H2O-2e-=SO42-+3H+,阳极区逸出气体的成分为O2、SO2(填化学式).
4.下列说法正确的是( )
| A. | 温度和压强一定时,对于可逆反应:2NO2(g)?N2O4(g),混合气体的密度不再改变,则反应达到平衡状态 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1,说明金刚石更稳定 |
1.下列离子方程式书写正确的是( )
| A. | Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++4Br-+3Cl2═2Fe2++2Br2+6Cl- | |
| B. | NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时,4OH-+3SO2═SO32-+2HSO3-+H2O | |
| C. | 酚酞滴入碳酸钠溶液中,溶液变红:CO32-+H2O═HCO3-+OH- | |
| D. | 将铝条投入NaOH溶液中:Al+OH-+H2O═AlO2-+H2↑ |
2.从下列事实所列出的相应结论正确的是( )
| 实 验 事 实 | 结 论 | |
| ① | Cl2的水溶液可以导电 | Cl2是电解质 |
| ② | 将烧红的铁片插入水中生成氢气 | 还原性:Fe>H2 |
| ③ | 向久置空气的漂白粉中加盐酸有CO2气体产生 | 酸性:H2CO3>HClO |
| ④ | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某无色溶液中加入氢氧化钠浓溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定含有NH4+ |
| A. | ③④⑤ | B. | ②③⑤ | C. | ①②③ | D. | 全部 |

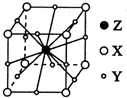 X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上.Y2-的M能层的原子轨道为全空状态.Z的单质用作铝热反应的引燃剂,化合物ZW2的晶体为离子晶体. W与X形成的化合物是一种常见的有机溶剂n.A为第四周期元素,其基态原子含有6个未成对电子.
X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上.Y2-的M能层的原子轨道为全空状态.Z的单质用作铝热反应的引燃剂,化合物ZW2的晶体为离子晶体. W与X形成的化合物是一种常见的有机溶剂n.A为第四周期元素,其基态原子含有6个未成对电子.