题目内容
金属氢化物-镍(MH-Ni)电池由于其高能、安全、无污染、无记忆效应、价格适宜,已成为目前最具发展前景的“绿色能源”电池之一,电池总反应为MH+NiOOH
M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金.电解质溶液为浓KOH溶液.
(1)写出放电时的负极反应
(2)充电时,阳极的电极反应为
镍氢电池正极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成.某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+

②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
回答下列问题:
(3)根据上表数据判断步骤②先析出的沉淀Ⅱ为 ,后析出的沉淀为Ⅲ为 (填化学式),则pH1 pH2(填填“>”、“=”或“<”),
(4)已知溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O,则③的化学方程式是 .
(5)④中阳极的电极反应为 ,验证阳极产物的试剂为 .
(6)试写出⑥的离子方程式 .
| 放电 |
| 充电 |
(1)写出放电时的负极反应
(2)充电时,阳极的电极反应为
镍氢电池正极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成.某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+

②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
| M(OH)x | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
(3)根据上表数据判断步骤②先析出的沉淀Ⅱ为
(4)已知溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O,则③的化学方程式是
(5)④中阳极的电极反应为
(6)试写出⑥的离子方程式
考点:原电池和电解池的工作原理,物质分离和提纯的方法和基本操作综合应用
专题:实验设计题,电化学专题
分析:(1)放电时,负极上失电子发生氧化反应;
(2)充电时Ni(OH)2在阳极上失电子发生氧化反应;
(3)废旧镍电池电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成的,根据流程图,加入盐酸,其中碳粉不反应得到残渣.得到溶液A的推断,利用题中给的信息,NiCl2易溶于水,Fe3+不能氧化Ni2+,推知A中含有被盐酸溶解生成的Ni2+、Fe3+、AI3+三种离子;
由题给条件,根据PH可以确定开始析出沉淀和全部沉淀的PH范围,先析出沉淀Ⅱ是Fe(OH)3,沉淀PH范围是2.53~2.94,然后析出沉淀Ⅲ是Al(OH)3,沉淀PH的范围3.43~4.19,所以PH1<PH2;
(4)流程中得到的B溶液中主要是Ni2+,加入Na2C2O4溶液,生成了沉淀Ⅰ和D,已知溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O,所以生成的沉淀Ⅰ为NiC2O4?2H2O;
(5)由流程图和以上分析可知,D溶液主要是氯化钠溶液,电解氯化钠溶液在阳极得到氯气,氯气具有氧化性,验证氯气的试剂应是淀粉碘化钾溶液,遇氯气变蓝;
(6)在B溶液中加入Na2C2O4溶液生成了沉淀ⅠNiC2O4.2H2O,沉淀中加入氢氧化钠溶液,根据Ni(OH)2开始沉淀到全部沉淀的PH范围为7.60~9.75,加入过量氢氧化钠溶液能使沉淀NiC2O4.2H2O转化为Ni(OH)2,所以C为沉淀Ni(OH)2;根据流程图中的转化关系,Ni(OH)2和氯气能生成Ni(OH)3,结合原子守恒写成离子方程式.
(2)充电时Ni(OH)2在阳极上失电子发生氧化反应;
(3)废旧镍电池电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成的,根据流程图,加入盐酸,其中碳粉不反应得到残渣.得到溶液A的推断,利用题中给的信息,NiCl2易溶于水,Fe3+不能氧化Ni2+,推知A中含有被盐酸溶解生成的Ni2+、Fe3+、AI3+三种离子;
由题给条件,根据PH可以确定开始析出沉淀和全部沉淀的PH范围,先析出沉淀Ⅱ是Fe(OH)3,沉淀PH范围是2.53~2.94,然后析出沉淀Ⅲ是Al(OH)3,沉淀PH的范围3.43~4.19,所以PH1<PH2;
(4)流程中得到的B溶液中主要是Ni2+,加入Na2C2O4溶液,生成了沉淀Ⅰ和D,已知溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O,所以生成的沉淀Ⅰ为NiC2O4?2H2O;
(5)由流程图和以上分析可知,D溶液主要是氯化钠溶液,电解氯化钠溶液在阳极得到氯气,氯气具有氧化性,验证氯气的试剂应是淀粉碘化钾溶液,遇氯气变蓝;
(6)在B溶液中加入Na2C2O4溶液生成了沉淀ⅠNiC2O4.2H2O,沉淀中加入氢氧化钠溶液,根据Ni(OH)2开始沉淀到全部沉淀的PH范围为7.60~9.75,加入过量氢氧化钠溶液能使沉淀NiC2O4.2H2O转化为Ni(OH)2,所以C为沉淀Ni(OH)2;根据流程图中的转化关系,Ni(OH)2和氯气能生成Ni(OH)3,结合原子守恒写成离子方程式.
解答:
解:(1)放电时是原电池、充电时是电解池,蓄电池放电时,负极上MH失电子发生氧化反应,电极反应式为MH+OH--e-═M+H2O,
故答案为:MH+OH--e-═M+H2O;
(2)充电时Ni(OH)2在阳极上失电子发生氧化反应,其阳极的电极反应式为Ni(OH)2-e-+OH-=NiOOH+H2O;
故答案为:Ni(OH)2-e-+OH-=NiOOH+H2O;
(3)根据金属氢氧化物的Kap及沉淀析出的理论pH,结合流程图可知,先沉淀的是三价铁离子,随后沉淀的是三价铝离子,则先析出沉淀Ⅱ是Fe(OH)3,沉淀PH范围是2.53~2.94,然后析出沉淀Ⅲ是Al(OH)3,沉淀PH的范围3.43~4.19,所以PH1<PH2;,
故答案为:Fe(OH)3;Al(OH)3;<;
(4)由溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O和流程中的变化可知沉淀为溶解度小的NiC2O4?2H2O,所以根据转化关系写出化学方程式:NiCl2+Na2C2O4+2H2O=NiC2O4.2H2O↓+2NaCl,
故答案为:NiCl2+Na2C2O4+2H2O=NiC2O4.2H2O↓+2NaCl;
(5)由流程图和以上分析可知,D溶液主要是氯化钠溶液,电解氯化钠溶液在阳极得到氯气,则阳极反应式为:2Cl-2e-=Cl2↑;氯气具有氧化性,验证氯气的试剂应是淀粉碘化钾溶液,遇氯气变蓝,
故答案:2Cl-2e-=Cl2↑;淀粉碘化钾溶液;
(6)根据转化关系和Ni2+沉淀的PH推知,加入氢氧化钠的主要目的是把NiC2O4.2H2O沉淀转化为Ni(OH)2沉淀,为了使沉淀完全转化,加入的氢氧化钠溶液应过量,根据镍元素化合价变化,结合氧化还原反应的规律写出离子方程2Ni(OH)2+2OH-+Cl2=2Ni(OH)3+2Cl-,
故答案:2Ni(OH)2+2OH-+Cl2=2Ni(OH)3+2Cl-.
故答案为:MH+OH--e-═M+H2O;
(2)充电时Ni(OH)2在阳极上失电子发生氧化反应,其阳极的电极反应式为Ni(OH)2-e-+OH-=NiOOH+H2O;
故答案为:Ni(OH)2-e-+OH-=NiOOH+H2O;
(3)根据金属氢氧化物的Kap及沉淀析出的理论pH,结合流程图可知,先沉淀的是三价铁离子,随后沉淀的是三价铝离子,则先析出沉淀Ⅱ是Fe(OH)3,沉淀PH范围是2.53~2.94,然后析出沉淀Ⅲ是Al(OH)3,沉淀PH的范围3.43~4.19,所以PH1<PH2;,
故答案为:Fe(OH)3;Al(OH)3;<;
(4)由溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O和流程中的变化可知沉淀为溶解度小的NiC2O4?2H2O,所以根据转化关系写出化学方程式:NiCl2+Na2C2O4+2H2O=NiC2O4.2H2O↓+2NaCl,
故答案为:NiCl2+Na2C2O4+2H2O=NiC2O4.2H2O↓+2NaCl;
(5)由流程图和以上分析可知,D溶液主要是氯化钠溶液,电解氯化钠溶液在阳极得到氯气,则阳极反应式为:2Cl-2e-=Cl2↑;氯气具有氧化性,验证氯气的试剂应是淀粉碘化钾溶液,遇氯气变蓝,
故答案:2Cl-2e-=Cl2↑;淀粉碘化钾溶液;
(6)根据转化关系和Ni2+沉淀的PH推知,加入氢氧化钠的主要目的是把NiC2O4.2H2O沉淀转化为Ni(OH)2沉淀,为了使沉淀完全转化,加入的氢氧化钠溶液应过量,根据镍元素化合价变化,结合氧化还原反应的规律写出离子方程2Ni(OH)2+2OH-+Cl2=2Ni(OH)3+2Cl-,
故答案:2Ni(OH)2+2OH-+Cl2=2Ni(OH)3+2Cl-.
点评:本题考查了原电池和电解池原理的应用、金属回收的基本方法、难溶电解质的溶解与沉淀应用、沉淀转化的条件,铝、铁、镍元素化合物的化学性质,离子的沉淀PH范围,物质的分离、提纯的方法,实验基本操作等,题目涉及的知识点较多,侧重于考查学生对知识的综合应用能力,题目难度较大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
2011年3月11日下午1点46分,日本发生了大海啸.为确保大灾之后无大疫,日本防疫部门使用了大量含氯类消毒剂,其中ClO2是杀菌效率高的杀毒剂,具有强氧化性.工业上制备ClO2化学反应的方程式为:2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+2H2O,下列有关说法正确的是( )
| A、在反应中NaClO3是还原剂,Na2SO3是氧化剂 |
| B、有反应可得ClO2的氧化性大于NaClO3的氧化性 |
| C、该反应中,H2SO4中各元素的化合价没有发生变化 |
| D、1mol NaClO3参加反应,则有2mol电子转移 |
下列情况不会对人体健康造成危害的是( )
| A、海产品用福尔马林(35%~40%的甲醛水溶液)浸泡进行防腐保鲜 |
| B、用SO2漂白食品以增强美观 |
| C、将含甲醇(CH3OH,对视神经有破坏作用)的工业酒精兑制成折酒 |
| D、自来水中通入少量Cl2进行消毒杀菌 |
下列叙述正确的是( )
| A、1mol任何气体的体积一定是22.4L |
| B、在非标准状况下,1mol任何气体的体积不可能是22.4L |
| C、在标准状况下,体积为22.4L的物质都是1mol |
| D、标准状况下,22.4L的任何气体中都约含有6.02×1023个分子 |
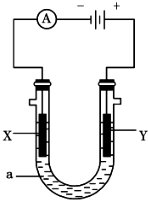 (1)电解池中与外电源负极相连的电极反应式为
(1)电解池中与外电源负极相连的电极反应式为