题目内容
5.下列物质中既能与盐酸又能与氢氧化钠溶液反应的是( )| A. | Al2O3 | B. | Fe2O3 | C. | CO2 | D. | SiO2 |
分析 Al、Al2O3、Al(OH)3、弱酸的酸式盐、弱酸的铵盐、氨基酸、蛋白质等物质都能和强酸、强碱反应,据此分析解答.
解答 解:A.Al2O3属于两性氧化物,能和稀盐酸、NaOH溶液反应生成盐和水,故A正确;
B.Fe2O3属于碱性氧化物,能和稀盐酸反应生成盐和水,和碱不反应,故B错误;
C.二氧化碳属于酸性氧化物,能和NaOH溶液反应生成盐和水,故C错误;
D.二氧化硅属于酸性氧化物,和稀盐酸不反应,能和NaOH反应生成盐和水,故D错误;
故选A.
点评 本题考查两性氢氧化物、两性氧化物等知识点,侧重考查元素化合物知识,熟悉常见元素化合物知识,总结归纳并灵活运用,注意氢氧化铝不溶于弱碱,题目难度不大.

练习册系列答案
相关题目
10.某学生以铁丝和Cl2为原料进行下列三个实验.从分类角度下列分析正确的是( )

| A. | 实验①所涉及的物质均为电解质 | |
| B. | 实验②、③得到的分散系中分散质粒子的直径:②>③ | |
| C. | 实验③得到的物质能产生丁达尔现象 | |
| D. | 实验③反应制得的物质为纯净物 |
17.下列实验设计、操作或实验现象不合理的是( )
| A. | 实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流 | |
| B. | 检验甲酸中是否混有乙醛,可向样品中加入足量NaOH溶液以中和甲酸后,再做银镜反应实验或与新制Cu(OH)2共热的实验 | |
| C. | 除去苯中的少量苯酚:加入适量NaOH溶液,振荡、静置、分液 | |
| D. | 液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入稀硝酸酸化,再加入AgNO3溶液检验溴乙烷中是否含有溴元素 |
15. 以下元素均为短周期元素:
以下元素均为短周期元素:
(1)D的最低价含氧酸的电子式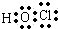 .
.
(2)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式2NH3-6e-+6OH-═N2+6H2O.
(3)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比1:1反应的离子方程式为CO32-+Cl2+H2O=ClO-+Cl-+HCO-3.
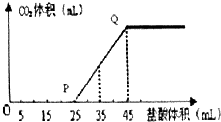
(4)A的最高价氧化物的水化物的溶液中通入一定量CO2得溶液X,X中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
①X溶液中溶质的化学式NaOH和Na2CO3.
②当加入35mL盐酸时,产生CO2的体积为224mL(标准状况).
 以下元素均为短周期元素:
以下元素均为短周期元素:| 元素代号 | 相关信息 |
| M | 非金属元素,其气态氢化物的水溶液呈碱性 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第三周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是常用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
 .
.(2)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式2NH3-6e-+6OH-═N2+6H2O.
(3)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比1:1反应的离子方程式为CO32-+Cl2+H2O=ClO-+Cl-+HCO-3.
(4)A的最高价氧化物的水化物的溶液中通入一定量CO2得溶液X,X中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
①X溶液中溶质的化学式NaOH和Na2CO3.
②当加入35mL盐酸时,产生CO2的体积为224mL(标准状况).
 ,其原子核外共有22种运动状态不相同的电子.金属钛晶胞如下图1所示,为六方最密堆积(填堆积方式).
,其原子核外共有22种运动状态不相同的电子.金属钛晶胞如下图1所示,为六方最密堆积(填堆积方式).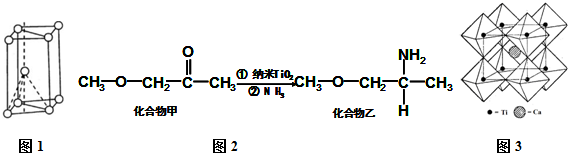
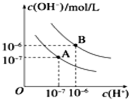 已知水在25℃和100℃时,其电离平衡曲线如图所示:
已知水在25℃和100℃时,其电离平衡曲线如图所示: