题目内容
13.近年来,许多城市将公共汽车的燃料换成甲醇(CH3OH),以减少汽车尾气对环境造成的污染.(1)某校研究性学习小组的同学为了探究甲醇在氧气中燃烧的产物,他们将甲醇在氧气中点燃,再用燃烧后的混合气体通过如下的装置进行实验(铁架台等装置已略去):
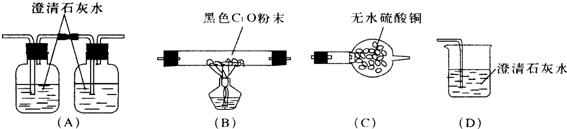
请你设计这些装置的连接顺序(装置不重复使用),使实验尽可能多地检验出甲醇燃烧的产物(用装置的编号表示);混合气体→C、A、B→D.
(2)学习小组的同学通过正确的设计并进行实验,在实验过程中观察到的部分现象如下:
D和A中左边装置内的澄清石灰水均变浑浊,而A中右边装置内的澄清石灰水不变浑浊.请结合反应原理和实验现象进行分析,这次实验中甲醇的燃烧产物为一氧化碳、二氧化碳、水.
(3)通过该实验,请你谈谈应该怎样合理使用燃料燃料燃烧时要供给足量的氧气,防止因燃烧不充分产生一氧化碳而污染空气.
分析 甲醇中含有碳元素、氢元素和氧元素,在燃烧时可能产生一氧化碳、二氧化碳和水等物质,检验一氧化碳可以用氧化铜,检验二氧化碳可以用澄清石灰水,检验水常用无水硫酸铜,考虑到一氧化碳能够反应生成二氧化碳,所以应该先检验二氧化碳,然后鉴别一氧化碳,而气体通过澄清石灰水时会带出水蒸气,故应该最先检验水,然后是二氧化碳,最后检验一氧化碳,以此解答该题.
解答 解:(1)为了使实验尽可能多地检验出甲醇燃烧的产物,混合气体应该先通入C中,检验是否生成了水,再将气体通入A中,检验是否生成了二氧化碳,再将气体通入B和D中,检验是否生成了一氧化碳.
故答案为:C;A;B.
(2)D和A中左边装置内的澄清石灰水均变浑浊,而A中右边装置内的澄清石灰水不变浑浊,说明反应生成了一氧化碳和二氧化碳,同时通过C可以检验出生成了水,这次实验中甲醇的燃烧产物为一氧化碳、二氧化碳、水.
故答案为:一氧化碳、二氧化碳、水;
(3)使用燃料时,为了防止产生一氧化碳污染环境,应该提供足量的氧气,以避免燃料发生不完全燃烧.
故答案为:燃料燃烧时要供给足量的氧气,防止因燃烧不充分产生一氧化碳而污染空气.
点评 本题考查物质的性质以及实验方案的设计,为高考常见题型,注意合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础,题目难度不大.

练习册系列答案
相关题目
4.如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
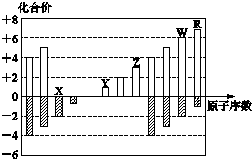

| A. | 离子半径:Z>Y>X | |
| B. | 最高正价氧化物对应的水化物的酸性:R<W | |
| C. | 氢化物的还原性:R>W | |
| D. | R的单质能与W的氢化物反应,可证明非金属性:R>W |
1.在无色溶液中能大量共存的一组离子是( )
| A. | Na+、CH3COO-、CO32-、OH- | B. | K+、Al3+、SO42-、AlO2- | ||
| C. | Na+、K+、SO32-、Fe3+ | D. | NH4+、H+、NO3-、HCO3- |
8.NA表示阿伏加德罗常数的值,下列判断正确的是( )
| A. | lmol Cu在适量硫蒸气中燃烧,得到的固体质量为80g | |
| B. | 分子数为NA的CO、C2H4的混合气体体积约为22.4L,质量为28g | |
| C. | 56g Fe投入足量冷的浓硝酸中,转移的电子数为3NA | |
| D. | 0.lmol1${\;}_{53}^{131}$I原子中含电子数为7.8NA |
5.下列物质中既能与盐酸又能与氢氧化钠溶液反应的是( )
| A. | Al2O3 | B. | Fe2O3 | C. | CO2 | D. | SiO2 |
 ,名称是3,4-二甲基辛烷.
,名称是3,4-二甲基辛烷.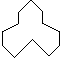 名称是环十二烷,1mol该烃完全燃烧,需消耗氧气18mol.
名称是环十二烷,1mol该烃完全燃烧,需消耗氧气18mol. 名称是3-甲基-4-乙基-3-己烯
名称是3-甲基-4-乙基-3-己烯 名称是2,2,3-三甲基戊烷
名称是2,2,3-三甲基戊烷