题目内容
一种含有结晶水的化合物A,能作为新型化学冷却降温材料.实验室在Mg(HCO3)2溶液中通入热的水蒸气,Mg(HCO3)2溶液经受热分解、沉淀转化等一系列反应,再经过滤、洗涤、干燥得到化合物A.
(1)化合物A能作为化学冷却降温材料,说明其分解是 (填“吸热”或“放热”)反应.
(2)对化合物A的成分做如下定性实验:取少量化合物A样品于试管中加热,将生成的所有气体依次通过无水CuSO4和澄清石灰水.试回答:
①无水CuSO4变蓝,可证明化合物A中除可能含 ,还可能含有 .
②澄清石灰水变浑浊,可证明化合物A的分解产物中含有 .
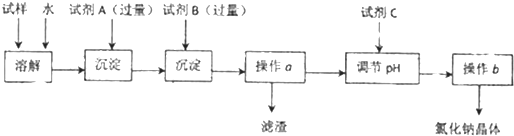
(3)化合物A的组成可初步确定为Mgx(CO3)y(OH)z?nH2O,为进一步确定该化合物A的成分,进行了如下定量研究:取4.84g化合物A加热分解,第一阶段为脱去全部结晶水,第二阶段最终剩余2.00g MgO固体.加热过程中,固体质量随温度的变化如图所示.请通过计算确定化合物A的化学式(写出计算过程).

(1)化合物A能作为化学冷却降温材料,说明其分解是
(2)对化合物A的成分做如下定性实验:取少量化合物A样品于试管中加热,将生成的所有气体依次通过无水CuSO4和澄清石灰水.试回答:
①无水CuSO4变蓝,可证明化合物A中除可能含
②澄清石灰水变浑浊,可证明化合物A的分解产物中含有
(3)化合物A的组成可初步确定为Mgx(CO3)y(OH)z?nH2O,为进一步确定该化合物A的成分,进行了如下定量研究:取4.84g化合物A加热分解,第一阶段为脱去全部结晶水,第二阶段最终剩余2.00g MgO固体.加热过程中,固体质量随温度的变化如图所示.请通过计算确定化合物A的化学式(写出计算过程).

考点:化学方程式的有关计算,反应热和焓变,镁、铝的重要化合物
专题:计算题
分析:(1)化合物A能作为化学冷却降温材料,说明分解时吸收热量;
(2)①无水CuSO4变蓝,说明生成水,可推知,化合物A可能可以结晶水或氢氧化镁;
②澄清石灰水变浑浊,说明生成二氧化碳气体;
(3)第一阶段为脱去全部结晶水,其质量为4.84g-3.94g,第二阶段生成CO2和H2O的总质量=3.94g-2.00g=1.94g,剩余2g为MgO,计算结晶水、MgO的物质的量,设CO32-和OH-的物质的量分别为a和b,根据生成二氧化碳、水的总质量及化合价规则列方程,进而确定化学式.
(2)①无水CuSO4变蓝,说明生成水,可推知,化合物A可能可以结晶水或氢氧化镁;
②澄清石灰水变浑浊,说明生成二氧化碳气体;
(3)第一阶段为脱去全部结晶水,其质量为4.84g-3.94g,第二阶段生成CO2和H2O的总质量=3.94g-2.00g=1.94g,剩余2g为MgO,计算结晶水、MgO的物质的量,设CO32-和OH-的物质的量分别为a和b,根据生成二氧化碳、水的总质量及化合价规则列方程,进而确定化学式.
解答:
解:(1)化合物A能作为化学冷却降温材料,说明分解时吸收热量,故答案为:吸热;
(2)①无水CuSO4变蓝,说明生成水,则A中含有结晶水或含有氢氧化镁,故答案为:结晶水;氢氧化镁;
②澄清石灰水变浑浊,说明生成二氧化碳气体,故答案为:CO2;
(3)n(H2O)=
=0.05mol,
n(Mg2+)=n(MgO)=
=0.05mol,
由图可得,CO2和H2O的总质量=3.94g-2.00g=1.94g;
又根据A的化学式Mgx(CO3)y(OH)z?nH2O,由化合价代数和为0得:2×x+(-2)×y+(-1)×z=0,即2y+z=2x,
设CO32-和OH-的物质的量分别为a和b,则:
,解得a=0.04,b=0.02,
则n(Mg2+):n(CO32-):n(OH-):n(H2O)=5:4:2:5,
故其化学式为Mg5(CO3)4(OH)2?5H2O,
故答案为:Mg5(CO3)4(OH)2?5H2O.
(2)①无水CuSO4变蓝,说明生成水,则A中含有结晶水或含有氢氧化镁,故答案为:结晶水;氢氧化镁;
②澄清石灰水变浑浊,说明生成二氧化碳气体,故答案为:CO2;
(3)n(H2O)=
| 4.84g-3.94g |
| 18g/mol |
n(Mg2+)=n(MgO)=
| 2.00g |
| 40g/mol |
由图可得,CO2和H2O的总质量=3.94g-2.00g=1.94g;
又根据A的化学式Mgx(CO3)y(OH)z?nH2O,由化合价代数和为0得:2×x+(-2)×y+(-1)×z=0,即2y+z=2x,
设CO32-和OH-的物质的量分别为a和b,则:
|
则n(Mg2+):n(CO32-):n(OH-):n(H2O)=5:4:2:5,
故其化学式为Mg5(CO3)4(OH)2?5H2O,
故答案为:Mg5(CO3)4(OH)2?5H2O.
点评:本题考查物质的含量和组成的测定,侧重于学生的分析能力、实验能力和计算能力的考查,为高考常见题型,明确各阶段发生的反应,结合质量的变化解答该题,难度中等.

练习册系列答案
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
已知H2(g)+
O2(g)=H2O(g);△H=-241.8kJ/mol.下列说法中不正确的是( )
| 1 |
| 2 |
| A、H2的燃烧热为-241.8kJ |
| B、2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol |
| C、1molH2完全燃烧生成液态水放出的热量大于241.8kJ |
| D、断开1molH2O的化学键吸收的总能量大于断裂1molH2和0.5 molO2的化学键所吸收的总能量 |
 对于敞口容器中的反应:Zn(s)+H2SO4(aq)=ZnSO4 (aq)+H2(g),反应过程中能量关系可用右图表示,下列叙述中不正确的是( )
对于敞口容器中的反应:Zn(s)+H2SO4(aq)=ZnSO4 (aq)+H2(g),反应过程中能量关系可用右图表示,下列叙述中不正确的是( )| A、1 molZn的能量高于1 molH2的能量 |
| B、反应物Zn和H2SO4的总能量高于产物 ZnSO4和H2的总能量 |
| C、如果Zn足量,反应速率会经历由慢到快到慢的过程 |
| D、用锌粉代替锌粒,速率会加快 |
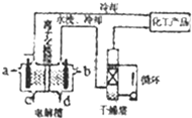 工业上电解饱和食盐水能制取多种化工原料,其设备示意图如图:
工业上电解饱和食盐水能制取多种化工原料,其设备示意图如图: