��Ŀ����
3��Cu2O��һ�־������ù��ЧӦ�IJ��ϣ�ijѧϰС��̽���Ʊ�Cu2O�ķ��������������ϡ�
��CuSO4��Na2SO3��Һ��Ͽ��Ʊ�Cu2O��
��Cu2OΪש��ɫ���壻��������������Cu2+��Cu��
��Cu2O��Cu��SO3��23-�����ת��Cu2O$?_{Cu_{2}+}^{SO_{32}-}$ Cu��SO3��23-����ɫ��
��1�����CuSO4��Һ��Na2SO3��Һ��Ӧ��Cu2O�����ӷ���ʽ��
��Cu2++��SO32-+��2H2O$\frac{\underline{\;\;��\;\;}}{\;}$��Cu2O��+��1SO42-+��HSO3-
��ʵ��̽����
| ���� | ���� |
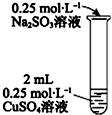 | i�л�ɫ�������֣�����Na2SO3��Һ�ĵ��룬�������ӣ����ӵ�5mLʱ����Һ����ɫ��ʧ�� ii���Թܼ��ȣ���ɫ������Ϊש��ɫ���д̼�����ζ��������� iii�ڼ��������£���������Na2SO3��Һ��ש��ɫ�������٣����ӵ�10mLʱ��������ȫ�ܽ⣬����ɫ��Һ�� |
A��Ũ���� B��ϡ���� C��Ũ���� D��ϡ����
��3��������i�л�ɫ��������Cu2SO3��ii�г����ɻ�ɫ��ש��ɫ�Ļ�ѧ����ʽ��Cu2SO3�TCu2O+SO2����
��4��iii��ש��ɫ������ʧ��ԭ����c��SO32-������ʹCu2O?Cu��SO3��23-ƽ�������ƶ���ש��ɫ������ʧ��
��5���ڼ��������£�����2mL0.25mol•L-1Na2SO3��Һ�еμ�0.25mol•L-1CuSO4��Һ��������Ԥ�ڹ۲쵽�������ǵõ���ɫ��Һ����������ש��ɫ���������д̼�����ζ�������ɣ�
��6��������ʵ��ó����ۣ�CuSO4��Һ��Na2SO3��Һ��Ӧ�Ʊ�Cu2O��Ӧ���Ƶ������Ƿ�Ӧ�¶ȡ�CuSO4��Na2SO3�����ʵ���֮�ȣ�
��7��������KOH��Һ�м���һ������CuSO4��Һ���ټ���һ�������£�N2H4�������Ȳ����ַ�Ӧ��ϵ���¶���90�棬��Ӧ��ȫ���롢ϴ�ӡ���ո������õ��Ĺ���Ϊ����������ͭ�����鷴Ӧ�����ϵ������Cu2O�Ѿ����ɵ�ʵ�鷽���Ƕ����ЧӦ��
���� ��1��CuSO4��Һ��Na2SO3��Һ��Ӧ����������ͭ�������һ��ͭ���ӽ���1�ۣ�һ�������������2�ۣ����ϼ����ߺͽ��͵����������ƽ�õ����ӷ���ʽ��
��2�����ݷ�ӦCu2O+H2SO4=CuSO4+Cu+H2O����Ӧ����Ϊ����ͭ���ʺ���ɫ��Һ��
��3��Cu2SO3�ֽ�����������ͭ�Ͷ�������
��4��Cu2O����Na2SO3��Ӧ����Cu��SO3��23-��
��5��CuSO4��Һ��Na2SO3��Һ��Ӧ����Cu2O��
��6��CuSO4��Һ��Na2SO3��Һ��Ӧ�õ�Cu2O��Cu2O��������ͭ��Ӧ������ɫCu��SO3��23-��
��7����Ӧ�����ϵ������Cu2O�γɵ��ǽ��壬��������Cu2O���Ǽ�����Һ�Ƿ���ж����ЧӦ��
��� �⣺��1��CuSO4��Һ��Na2SO3��Һ��Ӧ����������ͭ�������һ��ͭ���ӽ���1�ۣ�һ�������������2�ۣ����ӷ���ʽ��2Cu2++5SO32-+2H2O$\frac{\underline{\;\;��\;\;}}{\;}$1Cu2O+1SO42-+4HSO3-���ʴ�Ϊ��2��5��2H2O��1��1SO42-��4��
��2��Cu2O+H2SO4=CuSO4+Cu+H2O��ȡ����ש��ɫ�������Թ��У�����ϡ���ᣬ��Һ��Ϊ��ɫ��˵��ש��ɫ������Cu2O����ѡD���ʴ�Ϊ��D��
��3��Cu2SO3�ֽ�����������ͭ����ѧ����ʽCu2SO3�TCu2O+SO2�����ʴ�Ϊ��Cu2SO3�TCu2O+SO2����
��4��Cu2O����Na2SO3��Ӧ������ɫCu��SO3��23-��c��SO32-������ʹCu2O?Cu��SO3��23-ƽ�������ƶ���ש��ɫ������ʧ
�ʴ�Ϊ��c��SO32-������ʹCu2O?Cu��SO3��23-ƽ�������ƶ���ש��ɫ������ʧ��
��5���ڼ��������£�����2mL0.25mol•L-1Na2SO3��Һ�еμ�0.25mol•L-1CuSO4��Һ��������CuSO4��Һ��Na2SO3��Һ��Ӧ�õ���ɫ��Һ����������ש��ɫ���������д̼�����ζ�������ɣ�
�ʴ�Ϊ���õ���ɫ��Һ����������ש��ɫ���������д̼�����ζ�������ɣ�
��6��CuSO4��Һ��Na2SO3��Һ��Ӧ�õ�Cu2O��Cu2O��������ͭ��Ӧ������ɫCu��SO3��23-��Ӧ���ƽϸߵķ�Ӧ�¶ȣ�CuSO4��Na2SO3�����ʵ���֮��ԼΪ1��1���ʴ�Ϊ����Ӧ�¶ȣ�CuSO4��Na2SO3�����ʵ���֮�ȣ�
��7����������Cu2O���ڼ�����Һ�Ƿ���ж����ЧӦ���ʴ�Ϊ�������ЧӦ��
���� ���⿼�����ʵ��Ʊ���Ϊ�߿��������ͺ�Ƶ���㣬������ѧ���ķ���������ʵ�������Ŀ��飬ע����������Ϣ��������ʵ��������ʵ�鲽�裬��Ŀ�ѶȲ���

��1������480mL 0.1mol•L-1��Na2CO3��Һ��
| ʵ��Ӧ��Na2CO3����/g | Ӧѡ������ƿ�Ĺ��/mL |
A����30mLˮϴ���ձ�2��3�Σ�ϴ��Һ��ע������ƿ����
B����ȷ������Na2CO3���嵹���ձ��У��ټ�����ˮ�ܽ�
C��������ȴ����Һ�ز�����ע������ƿ��
D��������ƿ�ǽ������µߵ���ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ����ǡ����̶�������
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶���1cm��2cm��
��3�������������������������ҺŨ�Ƚ��к�Ӱ�죿���ƫ�ߡ���ƫ�͡�����Ӱ�족��������ƿ������������ˮ��Ӱ�죻������ʱ���ӿ̶���ƫ�ߣ�
��4����ʵ������г������������δ�����������ˮʱ���������˿̶��������ƣ�

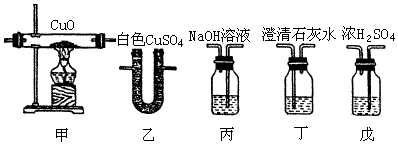
��1��д��װ��A�з�����Ӧ�����ӷ���ʽ��4H++2Cl-+MnO2 $\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O
��2��д���Լ�Y�����ƣ�����ʳ��ˮ��
��3����֪��ͨ��һ�������������D��ֻ��һ�ֳ�����Ϊ�ƺ�ɫ�����壬��Ϊ�������������ȷ������C�к��е�����ֻ��һ�֣��Һ���NaHCO3���ֶ�C�ɷֽ��в����̽����
������������裺
����һ���������ֳɷ֣�NaHCO3��NaCl
��������������ֳɷ֣�NaHCO3��NaCl��Na2CO3��
����Ʒ���������ʵ�飮��д��ʵ�鲽���Լ�Ԥ������ͽ��ۣ��ɲ���������
��ѡʵ���Լ�������������ˮ��ϡ���ᡢBaCl2��Һ������ʯ��ˮ��AgNO3��Һ���Թܡ�С�ձ���
| ʵ�鲽�� | Ԥ������ͽ��� |
| ����1��ȡC�е�����������Ʒ���Թ��У��μ���������ˮ�������ܽ⣬Ȼ��������Һ�ֱ�����A��B�Թ��У� | |
| ����2����A�Թ��е�BaCl2��Һ | ��������������֤�������в���̼���ƣ�������Һ����ǣ�֤�������к���̼���ƣ� |
| ����3����B�Թ��еμ�AgNO3��Һ��ϡ���� | ����Һ����ǣ���ϲ���2�еĢ٣������һ��������ϲ���2�еĢڣ������������� |
�����������������������ʵ�鷽�����ⶨC��NaHCO3����������$\frac{84��{m}_{1}-{m}_{2}��}{31{m}_{1}}$��100%��
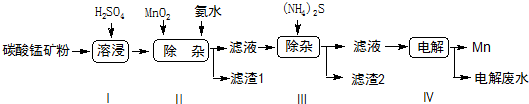
��֪25�棬�������ʵ��ܶȻ��������£�
| ���� | Mn��OH��2 | Co��OH��2 | Ni��OH��2 | MnS | CoS | NiS |
| Ksp | 2.1��10-13 | 3.0��10-16 | 5.0��10-16 | 1.0��10-11 | 5.0��10-22 | 1.0��10-22 |
��2��������У�MnO2�����������¿ɽ�Fe2+��������ΪFe3+����÷�Ӧ�����е����ӷ���ʽ��MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O���Ӱ�ˮ������Һ��pHΪ5.0-6.0���Գ�ȥFe3+��
��3��������У�����2����Ҫ�ɷ���CoS��NiS��
��4��������У��������������������������Mn���缫��Ӧ����ʽΪMn2++2e-=Mn��
��5����֪��S��s��+O2��g��=SO2��g����H=a kJ•mol-1
Mn��s��+S��s��+2O2��g��=MnSO4��s����H=b kJ•mol-1
MnO2��s��+SO2��g��=MnSO4��s����H=c kJ•mol-1����Mn��ȼ���ȡ�H=-�� a+c-b�� kJ•mol-1��
��6������ͼʾ���̣���MnCO3��������Ϊ57.5%��̼���̿�a kg�����յõ�Mn������Ϊ110b kg�������м���̵���ģ��������ʱ�����������Ԫ���൱��MnO2174b-0.435akg��[MnCO3Ħ������115g/mol��MnO2Ħ������87g/mol]��
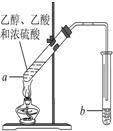
 ij����С����Ƶ�ʵ������ȡ����������װ����ͼ��ʾ��A�з���Ũ���ᣬB�з����Ҵ�����ˮ�����ƣ�D�з��б���̼������Һ��
ij����С����Ƶ�ʵ������ȡ����������װ����ͼ��ʾ��A�з���Ũ���ᣬB�з����Ҵ�����ˮ�����ƣ�D�з��б���̼������Һ����֪����ˮ�Ȼ��ƿ����Ҵ��γ�������ˮ��CaCl2•6C2H5OH
���й��л���ķе㣺
| �Լ� | ���� | �Ҵ� | ���� | �������� |
| �е㣨�棩 | 34.7 | 78.5 | 118 | 77.1 |
��1��Ũ����������Ǵ�������ˮ����
��2�����θ����C�������Ƿ�ֹ������Ӧ������D�е���������Һ�ֲ㣬�ϲ�Ϊ��ɫ��״Һ��
��3����D�з���������������г�����һ�������Ҵ������Ѻ�����ˮ��Ӧ�ȼ�����ˮ�Ȼ��ƣ�������Ҵ���Ȼ���ڻ��Һ�м����ʯ�������Ƭ���ټ��Ƚ��������ռ�77�����ҵ���֣��Ե�һ�ϴ���������������
| A�� | HCl | B�� | NH4Cl | C�� | NaHSO4 | D�� | H2SO4 |

 �����Ѿ��ܷⴢ��ʱ��Խ��������Խ�ã�ԭ��֮һ�Ǵ������������������ζ��������ʵ����Ҳ��������ͼ��ʾ��װ����ȡ������������ش��������⣮
�����Ѿ��ܷⴢ��ʱ��Խ��������Խ�ã�ԭ��֮һ�Ǵ������������������ζ��������ʵ����Ҳ��������ͼ��ʾ��װ����ȡ������������ش��������⣮