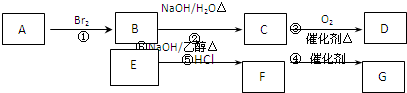
题目内容
 (1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②实验2条件下平衡常数K=
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
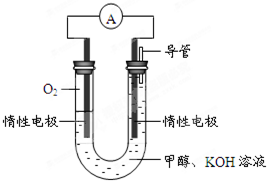
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池正极的电极反应为
该电池负极的电极反应为
②该电池工作时,溶液中的OH-向
考点:氧化还原反应方程式的配平,化学电源新型电池,反应速率的定量表示方法,化学平衡的影响因素
专题:
分析:(1)依据氧化还原电子守恒和原子守恒配平书写;
(2)①依据化学平衡三段式列式结合化学反应速率计算;
②计算实验1、2达到平衡的平衡常数比较判断反应进行的方向;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(4)①甲醇燃料电池,甲醇在负极失电子发生氧化反应碱溶液中生成碳酸盐,正极氧气得到电子生成氢氧根离子;
②原电池原理可知溶液中阴离子移向负极.
(2)①依据化学平衡三段式列式结合化学反应速率计算;
②计算实验1、2达到平衡的平衡常数比较判断反应进行的方向;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(4)①甲醇燃料电池,甲醇在负极失电子发生氧化反应碱溶液中生成碳酸盐,正极氧气得到电子生成氢氧根离子;
②原电池原理可知溶液中阴离子移向负极.
解答:
解:(1)碳元素化合价从0价变化为+4价,锰元素化合价从+7价变化为+2价,依据电子守恒,电子转移总数为20,所以碳和二氧化碳前系数为5,高锰酸钾和硫酸锰化学式前为4,结合原子守恒配平离子方程式为:5 C+4KMnO4+6 H2SO4=5CO2↑+4MnSO4+2K2SO4+6H2O,故答案为:5;4;6;4;2;
(2)①CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol) 4 2 0 0
变化量(mol) 1.6 1.6 1.6 1.6
平衡量(mol) 2.4 0.4 1.6 1.6
所以以v (CO2) 表示的反应速率=
=0.13mol/(L?min),故答案为:0.13mol/(L?min);
②实验1 CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) 2 1 0 0
变化量(mol/L) 0.8 0.8 0.8 0.8
平衡量(mol/L) 1.2 0.2 0.8 0.8
K1=
=2.7
实验2 CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) 1 0.5 0 0
变化量(mol/L) 0.2 0.2 0.2 0.2
平衡量(mol/L) 0.8 0.3 0.2 0.2
K2=
=0.17
温度升高,平衡常数减小,说明平衡逆向进行,逆向是吸热反应,正反应方向是放热反应;
故答案为:0.17; 放;
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
依据盖斯定律①-②得到2CH3OH(l)+2O2(g)=2CO(g)+4H2O(g)△H=-709.6KJ/mol;
化简得到甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-354.8KJ/mol;
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-354.8KJ/mol;
(4)①甲醇燃料电池,甲醇在负极失电子发生氧化反应碱溶液中生成碳酸盐,负极反应为CH3OH+8OH--6e-=CO32-+6H2O;正极氧气得到电子生成氢氧根离子,正极电极反应为:O2+4e-+2 H2O=4OH-,
故答案为:O2+4e-+2 H2O=4OH-;CH3OH+8OH--6e-=CO32-+6H2O;
②该电池工作时,依据原电池原理可知溶液中的OH-向负极移动,故答案为:负.
(2)①CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol) 4 2 0 0
变化量(mol) 1.6 1.6 1.6 1.6
平衡量(mol) 2.4 0.4 1.6 1.6
所以以v (CO2) 表示的反应速率=
| ||
| 6min |
②实验1 CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) 2 1 0 0
变化量(mol/L) 0.8 0.8 0.8 0.8
平衡量(mol/L) 1.2 0.2 0.8 0.8
K1=
| 0.8×0.8 |
| 1.2×0.2 |
实验2 CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) 1 0.5 0 0
变化量(mol/L) 0.2 0.2 0.2 0.2
平衡量(mol/L) 0.8 0.3 0.2 0.2
K2=
| 0.2×0.2 |
| 0.8×0.3 |
温度升高,平衡常数减小,说明平衡逆向进行,逆向是吸热反应,正反应方向是放热反应;
故答案为:0.17; 放;
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
依据盖斯定律①-②得到2CH3OH(l)+2O2(g)=2CO(g)+4H2O(g)△H=-709.6KJ/mol;
化简得到甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-354.8KJ/mol;
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-354.8KJ/mol;
(4)①甲醇燃料电池,甲醇在负极失电子发生氧化反应碱溶液中生成碳酸盐,负极反应为CH3OH+8OH--6e-=CO32-+6H2O;正极氧气得到电子生成氢氧根离子,正极电极反应为:O2+4e-+2 H2O=4OH-,
故答案为:O2+4e-+2 H2O=4OH-;CH3OH+8OH--6e-=CO32-+6H2O;
②该电池工作时,依据原电池原理可知溶液中的OH-向负极移动,故答案为:负.
点评:本题考查了氧化还原反应配平,原电池原理的分析判断,化学平衡影响因素和平衡常数的计算方法,热化学方程式计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列各组混合物总物质的量均为a mol,当每组物质以任意物质的量之比混合完全燃烧时,消耗O2的量不变的是( )
| A、甲烷、甲醇 |
| B、乙烯、环丙烷 |
| C、乙炔、苯 |
| D、乙醇、丙烯酸 |
下列叙述正确的是( )
| A、某无色溶液中加入稀盐酸,无明显变化,再加入Ba(NO3)2溶液后,产生白色沉淀,说明原来溶液中含有SO42- |
| B、在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 |
| C、向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 |
| D、过量的锌与浓硫酸反应产生的气体是SO2 |
下列说法中,在科学上没有错误的是( )
| A、吸带过滤嘴的香烟,对人体无害 |
| B、长期饮用纯净水,有可能引起一些微量元素的缺乏症 |
| C、纯天然物质配成的饮料,不含任何化学物质 |
| D、调味剂和营养剂加得越多越好 |