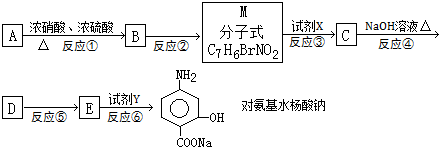
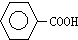题目内容
已知工业制造氢气的反应为CO(g)+H2O (g)═CO2(g)+H2(g)△H.在500℃时平衡常数K=9,400℃时的平衡常数K>9,若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol?L-1 ,反应在10min时达到平衡状态.
(1)增加H2O(g)的浓度,CO的转化率将 (填“增大”、“减小”或“不变”).
(2)平衡常数的表达式K= .400℃时平衡常数K (填“>”、“<”或“=”)0.
(3)500℃10min内v(H2O)= ,在此过程中体系的能量将 (填“增大”或“减少”);
(4)一定条件下,恒容密闭容器中,能表示上述反应的化学平衡状态的是 (填字母序号)
A.v逆(CO)=v正(H2O)
B.v正(H2O)=v正(H2)
C.混合气体的密度保持不变
D.c(CO2):c(H2)=1:1.
(1)增加H2O(g)的浓度,CO的转化率将
(2)平衡常数的表达式K=
(3)500℃10min内v(H2O)=
(4)一定条件下,恒容密闭容器中,能表示上述反应的化学平衡状态的是
A.v逆(CO)=v正(H2O)
B.v正(H2O)=v正(H2)
C.混合气体的密度保持不变
D.c(CO2):c(H2)=1:1.
考点:化学平衡的计算,化学平衡的影响因素,化学平衡状态的判断
专题:
分析:(1)增大反应物H2O(g)的浓度,平衡正向移动,CO的转化率增大;
(2)化学平衡常数是用生成物浓度的幂次方除以反应物浓度的幂次方,从500℃时平衡常数K=9,400℃时的平衡常数K>9,则降温平衡向正反应方向移动;
(3)根据500℃K=9,结合10min内v(H2O)=
进行计算,根据△H>0,反应向正反应方向进行判断能量变化;
(4)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
(2)化学平衡常数是用生成物浓度的幂次方除以反应物浓度的幂次方,从500℃时平衡常数K=9,400℃时的平衡常数K>9,则降温平衡向正反应方向移动;
(3)根据500℃K=9,结合10min内v(H2O)=
| △c |
| △t |
(4)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答:
解:(1)增大反应物H2O(g)的浓度,平衡正向移动,CO的转化率增大,故答案为:增大;
(2)化学平衡常数是用生成物浓度的幂次方除以反应物浓度的幂次方,所以,K=
;从500℃时平衡常数K=9,400℃时的平衡常数K>9,则降温平衡向正反应方向移动,则△H>0,故答案为:
;>;
(3)500℃10min内达到平衡状态,则设消耗H2O的物质的量为xmol,所以
有 CO(g)+H2O (g)═CO2(g)+H2(g)△H
开始 0.1 0.1 0 0
转化 x x x x
平衡0.1-x 0.1-x x x
K=
=9,解得x=0.075mol,所以10min内v(H2O)=
=0.00375mol/(L?min),根据△H>0,反应向正反应方向进行,则此过程中体系的能量将增大;故答案为:0.00375mol/(L?min),增大;
(4)A、根据反应速率之比等于系数之比,所以v逆(CO)=v逆(H2O)=v正(H2O),能说明到达平衡状态,故A正确;
B、都是指的正反应速率,不能说明到达平衡状态,故B错误;
C、混合气体的总质量不变,容器的体积不变,混合气体的密度始终不变,气体的密度不随时间改变,不能说明到达平衡状态,故C错误;
D、反应生成CO2和H2的物质的量始终按1:1生成,不能说明到达平衡状态,故D错误;
故选A.
(2)化学平衡常数是用生成物浓度的幂次方除以反应物浓度的幂次方,所以,K=
| [CO 2]?[H 2] |
| [CO]?[H 2O] |
| [CO 2]?[H 2] |
| [CO]?[H 2O] |
(3)500℃10min内达到平衡状态,则设消耗H2O的物质的量为xmol,所以
有 CO(g)+H2O (g)═CO2(g)+H2(g)△H
开始 0.1 0.1 0 0
转化 x x x x
平衡0.1-x 0.1-x x x
K=
| x×x |
| (0.1-x)×(0.1-x) |
| ||
| 10min |
(4)A、根据反应速率之比等于系数之比,所以v逆(CO)=v逆(H2O)=v正(H2O),能说明到达平衡状态,故A正确;
B、都是指的正反应速率,不能说明到达平衡状态,故B错误;
C、混合气体的总质量不变,容器的体积不变,混合气体的密度始终不变,气体的密度不随时间改变,不能说明到达平衡状态,故C错误;
D、反应生成CO2和H2的物质的量始终按1:1生成,不能说明到达平衡状态,故D错误;
故选A.
点评:本题考查平衡移动对反应物转化率的影响,以及化学平衡常数的求算和盖斯定律的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在铁制品上面镀上一定厚度的锌层,以下设计方案正确的是( )
| A、铁作阳极,镀件作阴极,溶液中含有亚铁离子 |
| B、铂作阴极,镀件作阳极,溶液中含有锌离子 |
| C、锌作阳极,镀件作阴极,溶液中含有锌离子 |
| D、锌用阴极,镀件作阳极,溶液中含有锌离子 |
下列做法中,会对人体造成较大危害的是( )
| A、用含氢氧化铝的药剂治疗胃酸过多 |
| B、用苏打中和发酵面团中的酸 |
| C、用醋酸清洗热水瓶内壁附着的水垢 |
| D、用二氧化硫熏蒸银耳 |
向含有Cu(NO3)2,Zn(NO3)2,Fe(NO3)3,AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充分搅拌反应后,下列结论错误的是( )
| A、溶液中析出0.05mol Cu |
| B、溶液中析出0.1mol Ag |
| C、溶液中Cu2+与Fe2+的浓度之比为1:2 |
| D、往反应后的溶液中再加入0.1mol 铁粉,铁粉恰好完全溶解 |
关于铁的叙述正确的是( )
①铁能被磁体吸引,纯铁易生锈
②在人体的血红蛋白中含有铁元素
③铁位于元素周期表中第四周期第ⅧB族
④铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧
⑤铁与强氧化剂硝酸反应的产物一定是Fe(NO3)3
⑥不能通过化合反应制得FeCl2和Fe(OH)3.
①铁能被磁体吸引,纯铁易生锈
②在人体的血红蛋白中含有铁元素
③铁位于元素周期表中第四周期第ⅧB族
④铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧
⑤铁与强氧化剂硝酸反应的产物一定是Fe(NO3)3
⑥不能通过化合反应制得FeCl2和Fe(OH)3.
| A、①③ | B、②④ | C、②⑤ | D、④⑥ |
某溶液中存在大量的OH-、Cl一、SO42一,该溶液中还可能大量存在的是( )
| A、HCO3一 |
| B、Ba2+ |
| C、K+ |
| D、Ag+ |
用鲍林的杂化轨道理论解释甲烷分子的正四面体结构,下列说法不正确的是( )
| A、C原子的四个杂化轨道的能量一样 |
| B、C原子的sp3杂化轨道之间夹角一样 |
| C、C原子有1个sp3杂化轨道由孤电子对占据 |
| D、C原子的4个价电子分别占据4个sp3杂化轨道 |
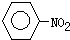
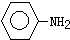 (苯胺,弱碱性、易氧化)
(苯胺,弱碱性、易氧化)