题目内容
15.下列说法正确的是( )| A. | 用米汤检验含碘盐中的碘元素 | |
| B. | 古代的陶瓷、砖瓦、现代的玻璃、水泥等,都是硅酸盐产品 | |
| C. | 乙酸乙酯在碱性条件下的水解反应称为皂化反应 | |
| D. | 甲烷会导致某些温泉有臭鸡蛋气味,塑料垃圾会造成水体富营养化 |
分析 A.淀粉遇碘变蓝色,但与碘酸钾不反应;
B.陶瓷、砖瓦、玻璃、水泥都含有硅酸盐成分;
C.油脂在碱性条件下的水解反应称为皂化反应;
D.硫化氢是一种具有臭鸡蛋气味的气体,P元素为水中藻类植物的营养物质.
解答 解:A.淀粉遇碘变蓝色,但与碘酸钾不反应,用米汤不能检验含碘盐中的碘酸钾,故A错误;
B.陶瓷、砖瓦、玻璃、水泥都含有硅酸盐成分,属于硅酸盐产品,故B正确;
C.油脂(高级脂肪酸甘油酯)在碱性条件下的水解反应称为皂化反应,工业生产中常用此反应来制取肥皂,故C错误;
D.硫化氢是一种具有臭鸡蛋气味的气体,甲烷无色无味,P元素为水中藻类植物的营养物质,则大量使用含磷洗涤剂会造成水体富营养化,故D错误.
故选B.
点评 本题考查较为综合,涉及物质的检验、硅酸盐以及有机物的结构和性质的考查,为高频考点,注意把握相关基础知识,学习中注意积累,难度不大.

练习册系列答案
相关题目
5.钴是重要的战略金属元素,钴及其化合物在化工、机械、航空和军事等部门具有广泛的应用.以水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等杂质)制取CoC2O4的工艺流程如图1:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
回答下列问题:
(1)浸出过程中加入Na2SO3的目的是将Fe3+、Co3+(填离子符号)还原.
(2)向浸出液中加入NaClO3的作用是将Fe2+氧化成Fe3+,反应的离子方程式为ClO3-+6Fe2++6H+═6Fe3++Cl-+3H2O.
(3)浸出液中加Na2CO3调pH至5.2时生成的沉淀为Fe(OH)3 Al(OH)3(填化学式),能够生成此沉淀的原因是铝离子、铁离子能与碳酸根离子发生双水解生成沉淀和二氧化碳,反应的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2、2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,从而产生沉淀(用离子方程式结合必要的文字说明).
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.
已知Ksp( MgF2)=7.35×10-ll、Ksp( CaF2)=1.05×10-10,当加入过量NaF后,所得滤液中$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7
(5)滤液Ⅱ中加入萃取剂的作用是除去Mn2+,萃取剂对金属离子的萃取率与pH的关系如图2所示.使用萃取剂适宜的pH是b(填字母).
a.接近2.0
b.接近3.0
c.接近4.0.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将Fe3+、Co3+(填离子符号)还原.
(2)向浸出液中加入NaClO3的作用是将Fe2+氧化成Fe3+,反应的离子方程式为ClO3-+6Fe2++6H+═6Fe3++Cl-+3H2O.
(3)浸出液中加Na2CO3调pH至5.2时生成的沉淀为Fe(OH)3 Al(OH)3(填化学式),能够生成此沉淀的原因是铝离子、铁离子能与碳酸根离子发生双水解生成沉淀和二氧化碳,反应的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2、2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,从而产生沉淀(用离子方程式结合必要的文字说明).
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.
已知Ksp( MgF2)=7.35×10-ll、Ksp( CaF2)=1.05×10-10,当加入过量NaF后,所得滤液中$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7
(5)滤液Ⅱ中加入萃取剂的作用是除去Mn2+,萃取剂对金属离子的萃取率与pH的关系如图2所示.使用萃取剂适宜的pH是b(填字母).
a.接近2.0
b.接近3.0
c.接近4.0.
6.化学在生产和生活中有重要的应用,下列说法不正确的是( )
| A. | 小苏打在生活中可用做发酵粉 | |
| B. | 过氧化钠可用于呼吸面具中氧气的来源 | |
| C. | 可溶性铁盐或铝盐可用于净水 | |
| D. | 二氧化硅可用于制作硅芯片和光电池 |
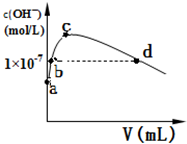
3.室温下,向10mL 0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是( )
| A. | 溶液中粒子的数目减小 | |
| B. | 再加入CH3COONa固体能促进醋酸的电离 | |
| C. | 稀释醋酸溶液,溶液中所有离子的浓度均降低 | |
| D. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 |
20.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 明矾与水反应成的Al(OH)3胶体能吸附水中悬浮物,可用于净水 | |
| B. | 江河入海口三角洲的形成通常与胶体的性质有关系 | |
| C. | 水泥厂、冶金厂用高压电作用于气溶胶以除去烟尘,是利用了电泳原理 | |
| D. | 溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸 |
7.某温度时,在容积为2L的三个恒容密闭容器中发生反应3A(g)+B(g)?xC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3mol A,2mol B | 6molA.4mol B | 2mol C |
| 达到平衡的时间/时间 | 5 | 8 | |
| A的平衡浓度/mol•L-1 | c1 | c2 | |
| C的体积分数/% | ω1 | ω2 | ω3 |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 若x>4,2c1<c2 | |
| B. | 若x=4,则ω1=ω2=ω3 | |
| C. | 只有当x=4时,2ρ1=ρ2 | |
| D. | 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间长 |
5.能证明氟化氢是弱电解质的事实是( )
| A. | 氟化氢在所有卤化氢中热稳定性最强 | |
| B. | 浓H2SO4加入氟化钙固体中,加热,有氟化氢气体产生 | |
| C. | 100ml 0.1 mol•Lˉ1氢氟酸中,c(H+)小于0.1 mol•Lˉ1 | |
| D. | 测得常温下0.1mol•L-1NaF溶液的pH>7 |
 CO2和CH4在一定条件下合成乙酸:CO2+CH4$\stackrel{TiO_{2}/Cu_{2}Al_{2}O_{4}}{→}$CH3COOH.完成下列填空:
CO2和CH4在一定条件下合成乙酸:CO2+CH4$\stackrel{TiO_{2}/Cu_{2}Al_{2}O_{4}}{→}$CH3COOH.完成下列填空: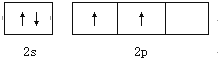 .
. ;其熔沸点比CO2高,原因是二者都为分子晶体,相对分子质量越大,分子间作用力越大.
;其熔沸点比CO2高,原因是二者都为分子晶体,相对分子质量越大,分子间作用力越大.