题目内容
2.材料是人类赖以生存和发展的重要物质基础,合理使用材料可以改善我们的生活.①在下列材料中,属于无机非金属材料的是c.属于塑料制品的是b.
a.涤纶 b.聚氯乙烯塑料 c.氮化硅陶瓷 d.玻璃钢
②玻璃、陶瓷、水泥的生产中,不需要使用石灰石作原料的是陶瓷(填“玻璃”、“陶瓷”或“水泥”).
③氧气和四氯化硅蒸气在旋转的高温炉中反应(发生置换反应),其产物之一可制得光导纤维,该反应的化学方程式为SiCl4+O2$\frac{\underline{\;高温\;}}{\;}$SiO2+2Cl2.
④钢铁在潮湿的空气中容易发生电化学腐蚀,写出一种防止钢铁生锈的方法:涂油漆、镀金属、制成不锈钢等.
分析 ①无机非金属材是以某些元素的氧化物、碳化物、氮化物、卤素化合物、硼化物以及硅酸盐、铝酸盐、磷酸盐、硼酸盐等物质组成的材料;塑料是以单体为原料,通过加聚或缩聚反应聚合而成的高分子化合物;
②生产原料不需要使用石灰石是陶瓷;
③四氯化硅与氧气反应生成二氧化硅和氯气;
④为防止铁被腐蚀,为防止铁腐蚀,要隔绝空气或、水,可以采用物理或化学方法.
解答 解:①a.涤纶属于合成纤维,故错误;
b.聚氯乙烯塑料属于塑料,故正确;
c.氮化硅陶瓷属于无机非金属材料,故正确;
d.玻璃钢属于复合材料,故错误.
故答案为:c;b;
②陶瓷的生产原料为粘土,不需要使用石灰石,故答案为:陶瓷;
③四氯化硅与氧气反应生成二氧化硅和氯气,方程式:SiCl4+O2$\frac{\underline{\;高温\;}}{\;}$SiO2+2Cl2,故答案为:SiCl4+O2$\frac{\underline{\;高温\;}}{\;}$SiO2+2Cl2;
④为防止铁被腐蚀,为防止铁腐蚀,要隔绝空气或、水,可以采用物理或化学方法,故答案为:涂油漆、镀金属、制成不锈钢等.
点评 本题考查无机非金属材料、合金、合成材料以及金属腐蚀与防护等知识,题目难度不大,明确物质的成分是解题的关键.

练习册系列答案
相关题目
13.下列化学方程式中,不能用离子方程式Ba2++SO42-═BaSO4↓表示的是( )
| A. | Ba(NO3)2+H2SO4═BaSO4↓+2HNO3 | B. | BaCl2+Na2SO4═BaSO4↓2NaCl | ||
| C. | BaCl2+H2SO4═BaSO4↓+2HCl | D. | BaCO3+H2SO4═BaSO4↓+H2O+CO2↑ |
10.下列说法中正确的是( )
| A. | 爆炸力极强的N5变成N2是化学变化 | |
| B. | 水晶、玛瑙、钻石的主要成分均为SiO2 | |
| C. | NaCl溶液和Fe(OH)3胶体可以用过滤的方法分离 | |
| D. | 向鸡蛋清溶液中加入(NH4)2SO4或CuSO4均有鸡蛋清析出,其原理相同 |
17.将下列各组物质按酸、碱、盐分类顺序排列正确的是( )
| A. | 硫酸 纯碱 硫酸钠 | B. | 氢溴酸 烧碱 绿矾 | ||
| C. | 碳酸 乙酸 醋酸钠 | D. | 磷酸 熟石灰 苛性钠 |
7.工业上为了处理含有Cr2O${\;}_{7}^{2-}$的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量已低于排放标准.关于上述方法,下列说法错误的是( )
| A. | 阳极反应:Fe-2e-═Fe2+ | |
| B. | 阴极反应:2H++2e-═H2↑ | |
| C. | 在电解过程中工业废水由酸性变为碱性 | |
| D. | 可以将铁电极改为石墨电极 |
14.设NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 含有NA个氦原子的氦气在标准状况下的体积为11.2L | |
| B. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| C. | 物质的量浓度为0.5mol/L的氯化镁溶液中,含有氯离子个数为NA | |
| D. | 常温常压下,32gO2和O3的混合气体所含原子数为2NA |
11.高锰酸钾[KMnO4]是常用的氧化剂.工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体.中间产物为锰酸钾[K2MnO4].图1是实验室模拟制备的操作流程:
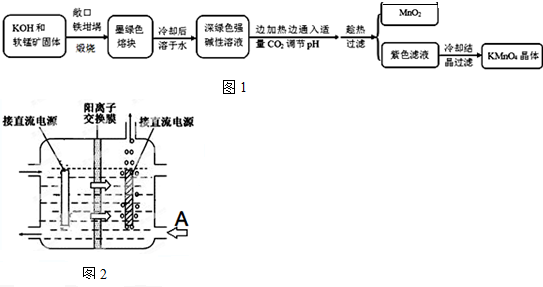
相关资料:
①物质溶解度
②锰酸钾[K2MnO4]
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是高温下强碱会和瓷坩埚中的二氧化硅反应腐蚀坩埚;
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O;
其中氧化还原反应中氧化剂和还原剂的质量比为1:2.
(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中A,得到的产品纯度更高.
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+H2↑+2KOH提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图).图2中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.

相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是高温下强碱会和瓷坩埚中的二氧化硅反应腐蚀坩埚;
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O;
其中氧化还原反应中氧化剂和还原剂的质量比为1:2.
(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中A,得到的产品纯度更高.
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+H2↑+2KOH提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图).图2中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.
12.向盛有100mLNH4Al(SO4)2溶液的烧杯中滴加NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
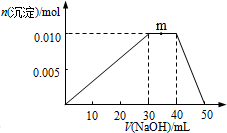
下列说法正确的是( )

下列说法正确的是( )
| A. | NH4Al(SO4)2的电离方程式为:NH4Al(SO4)2?NH4++Al3++2SO42- | |
| B. | m点反应的离子方程式:NH4++OH-═NH3•H2O | |
| C. | 反应过程中SO42-的浓度始终保持不变 | |
| D. | 由图象可知所滴NaOH溶液的浓度为0.1mol•L-1 |



