题目内容
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
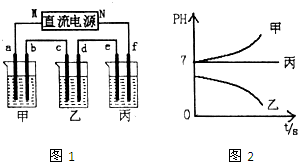
如图1所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极.接通电源,经过一端时间后,测得乙中c电极质量增加了27克.常温下各烧杯中溶液的pH与电解时间t的关系如图2.据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”),甲、乙电解质分别为 、 (填写化学式).
(2)要使电解后丙中溶液恢复到原来的状态,应加入 物质.(填写化学式)
(3)若电解后甲溶液的体积为25L,且产生的气体全部逸出.该溶液常温时的pH为 .
(4)写出乙烧杯中发生反应的离子方程式 .
(5)写出甲烧杯中发生反应的离子方程式 .
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
(1)M为电源的
(2)要使电解后丙中溶液恢复到原来的状态,应加入
(3)若电解后甲溶液的体积为25L,且产生的气体全部逸出.该溶液常温时的pH为
(4)写出乙烧杯中发生反应的离子方程式
(5)写出甲烧杯中发生反应的离子方程式

考点:电解原理
专题:电化学专题
分析:(1)接通电源,经过一段时间后,测得乙中C电极质量增加了27克,说明C电极是阴极,连接C电极的电源电极为负极;C电极上质量增加,析出金属单质,所以乙装置中含有银离子,电解乙装置中电解质溶液,溶液的pH值减小,所以阳极上析出氢氧根离子,根据离子的放电顺序判断电解质;电解时,甲装置中溶液的pH值增大,说明阴极上氢离子放电,阳极上放电能力比氢氧根离子强的离子放电,据此判断电解质.
(2)电解质在电解以后要想复原,符合的原则是:出什么加什么;
(3)根据电解方程式计算生成的氢氧化钠的浓度,进而计算溶液的pH;
(4)电解硝酸银溶液时,阳极上氢氧根离子放电,阴极上银离子放电,同时生成硝酸,写出相应的电池反应式;
(5)甲为氯化钠,电解氯化钠溶液,阳极氯离子放电,阴极氢离子放电,写出离子方程式.
(2)电解质在电解以后要想复原,符合的原则是:出什么加什么;
(3)根据电解方程式计算生成的氢氧化钠的浓度,进而计算溶液的pH;
(4)电解硝酸银溶液时,阳极上氢氧根离子放电,阴极上银离子放电,同时生成硝酸,写出相应的电池反应式;
(5)甲为氯化钠,电解氯化钠溶液,阳极氯离子放电,阴极氢离子放电,写出离子方程式.
解答:
解:(1)接通电源,经过一段时间后,测得乙中C电极质量增加了27克,说明C电极是阴极,所以连接阴极的电极M是原电池的负极;电解时,甲装置中溶液的pH值增大,说明阳极上是放电能力大于氢氧根离子的离子放电,根据表格知,为氯离子,氯离子和银离子能生成沉淀,所以甲装置电解质溶液是氯化钠溶液;电解时,装置乙中pH值减小,说明阳极上是氢离子放电,溶液中含有的阴离子是含氧酸根离子,阴极上析出金属,所以含有银离子,该电解质溶液是硝酸银溶液.
故答案为:负;NaCl;AgNO3;
(2)电解硫酸钠溶液实质是电解水,电解质在电解以后要想复原,符合的原则是:出什么加什么,所以要加入水才能复原,故答案为:H2O;
(3)乙中C电极质量增加了27克,根据Ag+e-=Ag,所以转移电子是
=0.25mol,电解甲溶液的电极反应式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,当转移电子0.25mol,生成氢氧化钠的物质的量是0.25mol,所以氢氧化钠的浓度是:
=0.01mol/L,所以溶液的pH=12,故答案为:12;
(4)电解硝酸银溶液时,阳极上氢氧根离子放电,阴极上银离子放电,电池反应式为:4Ag++2H2O
4 Ag+O2↑+4H+,
故答案为:4Ag++2H2O
4Ag+O2↑+4H+;
(5)甲为氯化钠,电解氯化钠溶液,阳极氯离子放电,阴极氢离子放电,反应的离子方程式为:2Cl-+2H2O
Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-.
故答案为:负;NaCl;AgNO3;
(2)电解硫酸钠溶液实质是电解水,电解质在电解以后要想复原,符合的原则是:出什么加什么,所以要加入水才能复原,故答案为:H2O;
(3)乙中C电极质量增加了27克,根据Ag+e-=Ag,所以转移电子是
| 27g |
| 108g/mol |
| ||
| 0.25mol |
| 25L |
(4)电解硝酸银溶液时,阳极上氢氧根离子放电,阴极上银离子放电,电池反应式为:4Ag++2H2O
| ||
故答案为:4Ag++2H2O
| ||
(5)甲为氯化钠,电解氯化钠溶液,阳极氯离子放电,阴极氢离子放电,反应的离子方程式为:2Cl-+2H2O
| ||
故答案为:2Cl-+2H2O
| ||
点评:本题考查了电解池原理,明确“C电极上质量的变化”的意思是解本题的关键,根据电解质各电极上发生反应的类型即可解答本题,难度不大.

练习册系列答案
相关题目
环境污染已经严重威胁着人类社会的生存与发展就,下列与环境污染无关的是( )
| A、潮汐 | B、酸雨 |
| C、温室效应 | D、光化学烟雾 |
为了社会可持续发展,化工生产过程应尽量减少对环境的负作用.“绿色化学”是当今社会提出的一个新概念,它要求从经济、环保和技术上设计可行的化学反应.据此,由单质铜制取硝酸铜的下列衍变关系可行且符合“绿色化学”的是( )
A、Cu
| ||||||
B、Cu
| ||||||
C、Cu
| ||||||
D、Cu
|
化学与人类生活、工农业生产、科学技术等息息相关,下列说法正确的是( )
| A、在涂料中尽量用液态有机物代替水作溶剂以减少环境污染 |
| B、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,PM2.5比胶体粒子小,因其比表面积大,故可吸附重金属离子,入肺后对人体产生很大的危害 |
| C、石油分馏可获得乙烯、丙烯和丁二烯 |
| D、新型无机非金属材料Si3N4、Al2O3可以用于制作高温结构陶瓷制品 |
地球大气臭氧层集中在离地面20~30km以上的平流层,它消耗太阳向地球辐射的紫外线能量的99%.近年来,臭氧不断减少,在两极出现了臭氧空洞,人类皮肤癌、白内障等疾病患者明显增加,海洋生物减少.这是由于过量紫外线照射( )
| A、引起空气发生化学变化 |
| B、产生杀菌消毒作用 |
| C、诱发动植物的基因突变 |
| D、造成病毒感染 |
铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
下列计算结果错误的是( )
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9.6 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
| A、实验①中硝酸只和铁粉反应 |
| B、原混合物总质量为105.6g |
| C、硝酸浓度为4mol?L-1 |
| D、V=6720 |