题目内容
11.当前环境问题是一个全球重视的问题,引起环境问题的气体常见的有温室气体CO2、污染性气体NOx、SOx等.如果对这些气体加以利用就可以成为重要的能源,既解决了对环境的污染,又解决了部分能源危机问题.(1)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料.CO2与H2反应制备CH3OH和H2O的化学方程式为CO2+3H2$\frac{\underline{\;一定条件\;}}{\;}$CH3OH+H2O
(2)在高温下一氧化碳可将二氧化硫还原为单质硫.
已知:①C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
②CO2(g)+C(s)═2CO(g)△H2=+172.5kJ•mol-1
③S(s)+O2(g)═SO2(g)△H3=-296.0kJ•mol-1
请写出CO与SO2反应的热化学方程式2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1.
(3)硝酸厂常用催化还原方法处理尾气.CH4在催化条件下可以将NO2还原为N2.
已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-889.6kJ•mol-1①
N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ•mol-1②
则CH4还原NO2生成水蒸气和氮气的热化学方程式是CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g)△H=-957.3kJ•mol-1.
分析 (1)CO2与H2反应生成CH3OH和H2O,根据原子守恒配平书写方程式;
(2)由题意可知,发生反应:2CO+SO2=S+2CO2,根据盖斯定律,①-②-③可得CO与SO2反应的热化学方程式;
(3)发生反应:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g),根据盖斯定律可知,①-②可得热化学方程式.
解答 解:(1)CO2与H2反应生成CH3OH和H2O,根据原子守恒配后反应方程式为:CO2+3H2$\frac{\underline{\;一定条件\;}}{\;}$CH3OH+H2O,
故答案为:CO2+3H2$\frac{\underline{\;一定条件\;}}{\;}$CH3OH+H2O;
(2)由题意可知,发生反应:2CO+SO2=S+2CO2,
已知:①C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
②CO2(g)+C(s)=2CO(g)△H2=+172.5kJ•mol-1
③S(s)+O2(g)=SO2(g)△H3=-296.0kJ•mol-1
根据盖斯定律,①-②-③可得CO与SO2反应的热化学方程式:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1;
(3)发生反应:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g),根据盖斯定律可知,①-②可得热化学方程式:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g)△H=-957.3kJ•mol-1,
故答案为:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g)△H=-957.3kJ•mol-1.
点评 本题综合考查根据盖斯定律书写热化学方程式,为高频考点,侧重于学生的分析、计算能力的考查,难度不大,注意对盖斯定律的理解与应用.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | KClO3=K++Cl-+3O2- | B. | K2CO3=2K++CO32- | ||
| C. | NaOH=Na++OH- | D. | NH4Cl=NH4++Cl- |
| A. | 浓硫酸与铜 | B. | 浓硝酸与铜 | C. | 浓盐酸与MnO2 | D. | 浓氨水与CaO |
| A. |  腐蚀品 | B. |  爆炸品 | C. |  有毒气体 | D. |  易燃液体 |
下列有关NH3、H2的推断正确的是( )
| A. | 上述参加反应的NH3和生成H2的体积之比为3:2 | |
| B. | 同温同压下,NH3、H2的密度之比为2:17 | |
| C. | 相同质量的NH3、H2分子数之比为17:2 | |
| D. | 同温同体积下,相同质量NH3、H2的压强之比为2:17 |
| A. | 一定被氧化 | B. | 一定被还原 | ||
| C. | 可能被氧化或被还原 | D. | 一定同时被氧化和被还原 |
| A. |  分散系的分类 | |
| B. | 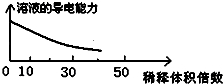 醋酸稀释 | |
| C. | 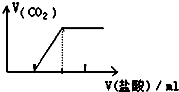 向Na2CO3溶液中逐滴滴入盐酸 | |
| D. | 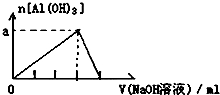 向AlCl3溶液中滴加过量的NaOH溶液 |
| A. | M2+ | B. | M | C. | M3+ | D. | MO2+ |
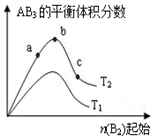 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图判断:
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图判断: